
|
��һ���¶��£���V L����̶����ܱ������м���1 mol��N2��3 mol��H2���������·�Ӧ��N2��3H2 ��������ѹǿ����ʱ��仯���仯 �ڻ��������ܶȲ���ʱ��仯���仯 ��NH3��Ũ�Ȳ��ٱ仯 ��N2��H2��NH3��Ũ��֮��Ϊ1��3��2 ��N2��H2��ת������� | |
| [����] | |
A�� |
�٢ڢ� |
B�� |
�ڢۢ� |
C�� |
�٢� |
D�� |
�ܢ� |
 Сѧ�̲���ȫ���ϵ�д�
Сѧ�̲���ȫ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��2011?�Ͽ���һģ����Դ������������������Դ���õ��ǵ����������Ż��⣮�������ѧ��ѧ֪ʶ�ش��������⣺
��2011?�Ͽ���һģ����Դ������������������Դ���õ��ǵ����������Ż��⣮�������ѧ��ѧ֪ʶ�ش��������⣺| �� �� | CO | H2 | CH3OH |
| Ũ��/��mol?L-1�� | 1.2 | 1.0 | 0.6 |
| c(CH3OH) |
| c(CO)c2(H2) |
| c(CH3OH) |
| c(CO)c2(H2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
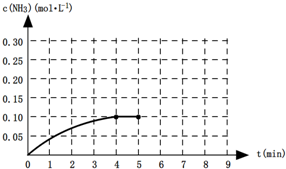
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ʱY��Ũ��Ϊ0.6mol/L | B��5min ��v��X��=0.06mol/��L?min�� | C��������X��Y��Z��Ũ��֮��Ϊ1��2��2����÷�Ӧ�ﵽƽ��״̬ | D����λʱ������0.1 molXͬʱ����0.2molZ����÷�Ӧ�ﵽƽ��״̬ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com