
| 4.72g |
| 5.00g |


科目:高中化学 来源: 题型:
| A、X、W、R的最高价氧化物的水化物酸性强弱顺序是X<W<R |
| B、气态氢化物的稳定性:Y>R |
| C、X、Y、W、R的原子半径由大到小的顺序为R>W>X>Y |
| D、X、W的氧化物由固态转化为气态时,克服相同的作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温、常压下,11.2 L N2含有的分子数为0.5NA |
| B、常温、常压下,1 mol Ne含有的原子数为NA |
| C、22.4L Cl2所含原子数为2NA |
| D、在同温、同压下,相同体积的任何气体单质所含分子数和原子数都相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、制取聚乙烯:nCH2═CH2→ | ||||
B、制取CuSO4:Cu+2H2SO4(浓)
| ||||
C、制取乙酸:CH3CHO+2Cu(OH)2
| ||||
D、制取Cu(NO3)2:2Cu+O2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
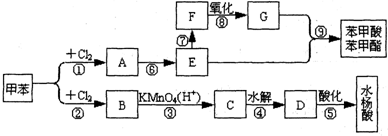
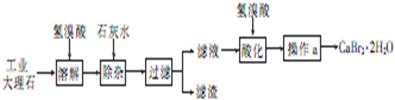
 ,请回答:
,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠与氧气反应,条件不同产物不同 |
| B、铁与水蒸汽在高温下的反应产物为Fe3O4和氢气 |
| C、钠加入CuSO4溶液中有气体产生并有红色的铜析出 |
| D、少量的钠可保持在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、符合该离子方程式的化学方程式可以是:HClO+HCl=Cl2↑+H2O |
| B、标准状况下,每生成1.12L Cl2,转移0.05NA电子 |
| C、在无色碱性溶液中,ClO-、Cl-、Al3+、Na+能大量共存 |
| D、洁厕灵(主要成分是盐酸)和84消毒液(主要成分是次氯酸钠)混合使用效果更好、更安全 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com