
| A. | 将25gKCl溶液蒸干得到5gKCl固体,则原溶液中溶质的质量分数为20% | |
| B. | 某物质中只含有一种元素,则该物质一定是纯净物 | |
| C. | 只有一种元素的阳离子和一种元素的阴离子构成的物质一定是纯净物 | |
| D. | 盐形成的溶液中,既不能电离出H+,也不能电离出OH- |
分析 A.依据溶质质量分数=$\frac{溶质质量}{溶液质量}$×100%判断解答;
B.含有一种元素的物质可能是单质,也可能是混合物;
C.氯化亚铁和氯化铁组成的混合物中只含有铁元素的阳离子和氯元素的阴离子;
D.酸式盐可电离出氢离子,碱式盐可电离出氢氧根离子.
解答 解:A、将25gKCl溶液蒸干得到5gKCl固体,则原溶液中溶质的质量分数为:$\frac{5g}{25g}$×100%=20%,故A正确;
B、某物质中只含有一种元素,则该物质不一定是纯净物,例如白磷和红磷组成的混合物中只含有一种元素--磷元素,故B错误;
C、只有一种元素的阳离子和一种元素的阴离子构成的物质不一定是纯净物,例如氯化亚铁和氯化铁组成的混合物中只含有铁元素的阳离子和氯元素的阴离子,故C错误;
D、盐形成的溶液中,可能电离出氢离子,也可能电离出氢氧根离子,例如盐硫酸氢钠能够电离出氢离子,盐碱式碳酸铜能够电离出氢氧根离子,故D错误;
故选:A.
点评 本题考查了物质的分类、溶液质量分数计算,明确质量分数计算公式、熟悉酸碱盐概念即可解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
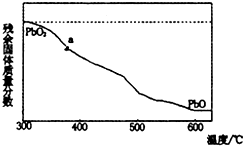 (1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3
(1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、K+、SO32-、MnO4- | |
| B. | pH=7的溶液中:Na+、Al3+、Cl-、SO42- | |
| C. | pH>12的溶液中:Na+、K+、SO42-、AlO2- | |
| D. | pH=0的溶液中:Na+、K+、NO3-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 操作 | 结论 |
| A | 配制FeCl2溶液时加入适量的盐酸 | 抑制Fe2+水解 |
| B | 浓硫酸和蔗糖反应产生的气体通过足量的KMnO4溶液,气体全部被吸收且溶液紫红色褪去 | “黑面包实验”产生的气体具有还原性 |
| C | 制备乙酸乙酯的实验,将蒸出的乙酸乙酯蒸汽导在饱和的NaOH溶液液面以上 | 防止倒吸,便于分层. |
| D | 幼儿使用含NaF的牙膏,可以使牙齿上的Ca5(PO4)3OH转化为Ca5(PO4)3F,防止蛀牙 | Ksp[Ca5(PO4)3F]<Ksp[Ca5(PO4)3OH] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2min的平均速率v(Z)=2.0×10-3 mol/(L•min) | |
| B. | 其他条件不变,降低温度,平衡向正反应方向移动 | |
| C. | 当进行4分钟时,反应已达平衡状态 | |
| D. | 其他条件不变,通过缩小容器体积增大压强,平衡常数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “低碳”意指更低的二氧化碳气体的排放 | |
| B. | 太阳能、水能、风能都属于可再生能源 | |
| C. | 太阳能电池的工作原理是光能与化学能的转换 | |
| D. | 利用燃气轮机进行天然气发电不属于可再生能源利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O、Na2O2组成元素相同,含有的阴、阳离子数目之比也相同 | |
| B. | 金属钠着火时,可用泡沫灭火器来灭火 | |
| C. | 钠与熔融的四氯化钛反应可制取钛 | |
| D. | 实验时用剩的钠块应该放回原试剂瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:3 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com