
| A. | 25℃,1.01×105Pa,64g SO2中含有的原子数为3NA | |
| B. | 足量Fe与1 mol Cl2反应,转移了3NA个电子 | |
| C. | 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 标准状况下,11.2L H2O含有的分子数为0.5NA |
分析 A.求出二氧化硫的物质的量,然后根据1mol二氧化硫中含3mol原子来分析;
B.2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,根据氯气和转移电子之间的关系式计算;
C.燃料电池中正极发生还原反应,氢氧燃料电池中正极氧气得到电子,1mol氧气完全反应得到4mol电子;
D.气体摩尔体积使用对象为气体;
解答 解:A.64g二氧化硫的物质的量为1mol,而1mol二氧化硫中含3mol原子即3NA个,故A正确;
B.2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,根据方程式知,1molFe完全反应需要氯气1.5mol,实际上有1mol氯气,则铁有剩余,1mol氯气生成氯离子转移2mol电子,故B错误;
C.标况下22.4L气体的物质的量为1mol,氢氧燃料电池中正极氧气得到电子,1mol氧气完全反应转移了4mol电子,则电路中通过的电子数目为4NA,故C错误;
D.标况下,水是液体,不能使用期气体摩尔体积,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是物质结构,氧化还原反应电子转移计算,气体摩尔体积的条件应用分析,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:推断题
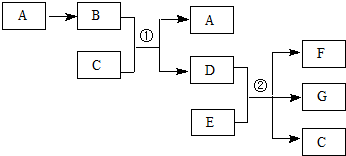
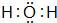 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
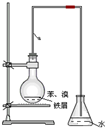 某同学设计如图装置制取少量溴苯,请回答下列问题:
某同学设计如图装置制取少量溴苯,请回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水、浓H2SO4 | B. | 酸性KMnO4溶液、浓H2SO4 | ||
| C. | 溴水、浓H2SO4 | D. | 浓H2SO4、NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 NaHSO3溶液中:c(Na+)+c(H+)═2c(SO32-)+c(HSO3-)+c(OH-) | |
| B. | 中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1 | |
| C. | pH=3的盐酸和pH=3的FeCl3溶液中,水电离出的c(H+)不相等 | |
| D. | 0.1mol•L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
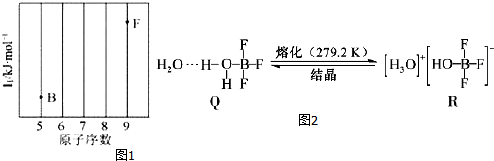
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
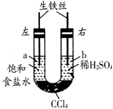 如图在盛有CCl4的U形管左右两端分别加入饱和食盐水和稀硫酸,使两边液面相平,再塞上插有铁丝的塞子,密封好,放置一段时间.下列说法错误的是( )
如图在盛有CCl4的U形管左右两端分别加入饱和食盐水和稀硫酸,使两边液面相平,再塞上插有铁丝的塞子,密封好,放置一段时间.下列说法错误的是( )| A. | 左右两边铁丝腐蚀速率一样快 | B. | 左右两边负极反应均为Fe-2e→Fe2+ | ||
| C. | 左边液面高于右边液面 | D. | 左右两边溶液的pH均升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com