
| ||
| ||
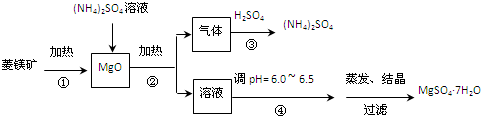


科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
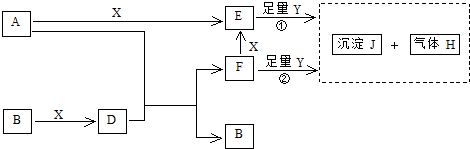
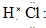
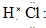
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体。丰中化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答。
![]() 【观察与思考】(1)乙醇分子的核磁共振氢谱有 个吸收峰。
【观察与思考】(1)乙醇分子的核磁共振氢谱有 个吸收峰。
![]() 【活动与探究】
【活动与探究】
![]() (2)甲同学向小烧杯中加入无水乙醇,再放入一小块金属钠(约绿豆粒大),观察实验现
(2)甲同学向小烧杯中加入无水乙醇,再放入一小块金属钠(约绿豆粒大),观察实验现
![]() 象。请在下表中将观察到的实验现象及结论补充完全(有多少现象等就填多少,不必填满)。
象。请在下表中将观察到的实验现象及结论补充完全(有多少现象等就填多少,不必填满)。
| 实验现象 | 结 论 |
① | 钠沉在乙醇下面 | 钠的密度大于乙醇 |
② |
|
|
|
|
|
|
|
|
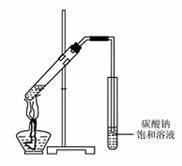 (3)乙同学向试管中加入3~4 mL无水乙醇,浸入50℃左右的热水中,再将铜丝烧至红热,迅速插入乙醇中,欲验证此实验的有机产物,可以将产物加入盛有 的试管中并在酒精灯火焰上直接加热煮沸,观察现象即可,此反应的化学方程式为 。
(3)乙同学向试管中加入3~4 mL无水乙醇,浸入50℃左右的热水中,再将铜丝烧至红热,迅速插入乙醇中,欲验证此实验的有机产物,可以将产物加入盛有 的试管中并在酒精灯火焰上直接加热煮沸,观察现象即可,此反应的化学方程式为 。
【交流与讨论】
(4)丙同学向一支试管中加入3 mL 乙醇,然后边摇动试管边慢慢加入2 mL浓硫酸和2 mL冰醋酸,按右图所示连接好装置,请指出该装置的主要错误是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体。丰中化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答。
![]() 【观察与思考】(1)乙醇分子的核磁共振氢谱有 个吸收峰。
【观察与思考】(1)乙醇分子的核磁共振氢谱有 个吸收峰。
![]() 【活动与探究】
【活动与探究】
![]() (2)甲同学向小烧杯中加入无水乙醇,再放入一小块金属钠(约绿豆粒大),观察实验现
(2)甲同学向小烧杯中加入无水乙醇,再放入一小块金属钠(约绿豆粒大),观察实验现
![]() 象。请在下表中将观察到的实验现象及结论补充完全(有多少现象等就填多少,不必填满)。
象。请在下表中将观察到的实验现象及结论补充完全(有多少现象等就填多少,不必填满)。
| 实验现象 | 结 论 |
① | 钠沉在乙醇下面 | 钠的密度大于乙醇 |
② |
|
|
|
|
|
|
|
|
 (3)乙同学向试管中加入3~4 mL无水乙醇,浸入50℃左右的热水中,再将铜丝烧至红热,迅速插入乙醇中,欲验证此实验的有机产物,可以将产物加入盛有 的试管中并在酒精灯火焰上直接加热煮沸,观察现象即可,此反应的化学方程式为 。
(3)乙同学向试管中加入3~4 mL无水乙醇,浸入50℃左右的热水中,再将铜丝烧至红热,迅速插入乙醇中,欲验证此实验的有机产物,可以将产物加入盛有 的试管中并在酒精灯火焰上直接加热煮沸,观察现象即可,此反应的化学方程式为 。
【交流与讨论】
(4)丙同学向一支试管中加入3 mL 乙醇,然后边摇动试管边慢慢加入2 mL浓硫酸和2 mL冰醋酸,按右图所示连接好装置,请指出该装置的主要错误是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com