
【题目】(1)写出NaHSO4在水中的电离方程式_____。
(2)粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,要除去这些杂质,可选用以下试剂:①Na2CO3、②NaOH、③BaCl2,则试剂加入的先后顺序是_____(填序号)。
(3)实验证明铜不能在低温下与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液的,则铜屑在此状态下被溶解的化学方程式为___________。
【答案】NaHSO4=Na++H++SO42- ②③①或③②① 2Cu+2H2SO4(稀)+O2![]() 2CuSO4+2H2O
2CuSO4+2H2O
【解析】
(1)NaHSO4在水中完全电离生成钠离子、氢离子和硫酸根离子;
(2)盐中含可溶性CaCl2、MgCl2及一些硫酸盐,先除去镁离子或硫酸根离子,再除去钙离子,过滤后,最后加盐酸,据此进行分析;
(3)铜与稀硫酸、氧气反应生成硫酸铜和水。
(1)NaHSO4在水中完全电离生成钠离子、氢离子和硫酸根离子,电离方程式为NaHSO4=Na++H++SO42-;
(2)粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,先加入②氢氧化钠溶液除去镁离子或加入③氯化钡溶液除去硫酸根离子,再加入适量①除去除去钙离子以及过量的钡离子,然后过滤除去难溶物,最后加盐酸,除去过量的碳酸钠、氢氧化钠,所以试剂的顺序为②③①或③②①;
(3)将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液,反应的化学方程式为2Cu+2H2SO4(稀)+O2![]() 2CuSO4+2H2O。
2CuSO4+2H2O。


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】25℃某二元碱B(OH)2水溶液中,B2+、B(OH)+和B(OH)2三者各自的物质的量分数δ随溶液pH的变化曲线如图所示,下列说法错误的是(已知多元碱的电离是逐级进行的)
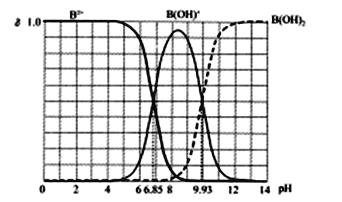
A. Kb2[B(OH)2]的数量级为10-8
B. 在B(OH)Cl溶液中c(OH-)>c(H+)
C. 等物质的量的BCl2和B(OH)Cl混合溶液中δ(B2+)<δ[B(OH)+]
D. B(OH)Cl溶液中,若c[B(OH)2]+2c(B2+)+c(H+)-c(OH-),则δ[B(OH)2]=δ[B(OH)+]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO 4)是一种新型、高效、多功能水处理剂,下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6□+8H2O。下列说法不正确的是
A. 每转移1mole-,可以得到33g K2FeO4
B. □处的物质应为KCl
C. 该反应中铁元素的化合价升高
D. 氧化性:Cl2>K2FeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应均可获取CO。下列有关说法正确的是
①木炭不完全燃烧制CO:2C(s)+O2(g)=2CO(g) ΔH1=-221kJ·mol-1
②木炭还原CO2制CO:C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
③焦炭还原Fe2O3制CO:Fe2O3(s) + 3C(s) ![]() 2Fe(s) + 3CO(g) ΔH 3=+489.0kJ·mol-1
2Fe(s) + 3CO(g) ΔH 3=+489.0kJ·mol-1
A. 反应①中化学能全部转化为热能
B. 反应②为吸热反应,在任何情况下都不能自发进行
C. 反应③中使用催化剂或移走部分CO,均可提高Fe2O3的转化率
D. 反应Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) ΔH =-28.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池的“理论比能量”指单位质量的电极材料理论上能释放的最大电能。“金属(M)空气电池”(如下图)具有原料易得、能量密度高等优点。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。下列说法不正确的是
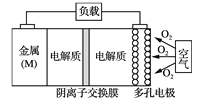
A. “金属(M)空气电池”放电过程的正极反应式: O2+2H2O+4e-=4OH-
B. 比较Mg、Al、Zn三种“金属—空气电池”,“Al—空气电池”的理论比能量最高
C. 电解质溶液中的阴离子从负极区移向正极区
D. 在“M—空气电池”中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有下列反应:
①2H2O+Cl2+SO2===H2SO4+2HCl
②2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O
根据上述两个反应回答:
(1)Cl2、KMnO4、H2SO4三者氧化性强弱顺序为______________,Cl-、SO2、Mn2+三者还原性强弱顺序为___________。
(2)反应①中氧化产物和还原产物的质量之比为________。
(3)反应②中浓盐酸表现出的性质是________。
A.还原性 B.酸性 C.氧化性
(4)用双线桥法标出反应②电子转移的方向和数目_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)我国首创以铝_空气_海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是________,负极反应为_____________;正极材料是__________,正极反应为_______________。
(2)熔盐电池具有高的发电效率,因而受到重视, 可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。阳极反应式:2CO+2CO![]() -4e-===4CO2,阴极反应式:____________,电池总反应式:____________ 。
-4e-===4CO2,阴极反应式:____________,电池总反应式:____________ 。
(3)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为_______________。若改用AlCl3水溶液作电解液,则阴极产物为_________。
(4) “镁-次氯酸盐”燃料电池的装置如图所示,该电池的正极反应式为_________________。
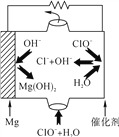
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如右图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )

A. 6:1 B. 3:1 C. 2:1 D. 1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
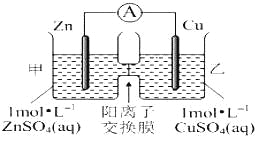
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的C(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阳离子通过交换膜向正极移动,阴离子通过交换膜向负极移动,保持溶液中电荷平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com