
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g) ΔH =-197 kJ·mol-1。在25 ℃时,向恒压密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出热量a1;若25 ℃时,在此恒压密闭容器中只通入1 mol SO2和0.5 mol O2,达到平衡时放出热量a2。则下列关系正确的是( )
2SO3(g) ΔH =-197 kJ·mol-1。在25 ℃时,向恒压密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出热量a1;若25 ℃时,在此恒压密闭容器中只通入1 mol SO2和0.5 mol O2,达到平衡时放出热量a2。则下列关系正确的是( )
A. 2a2=a1=197 kJ B. 2a2<a1<197 kJ
C. a2>a1>197 kJ D. 197 kJ>a1=2a2
【答案】D
【解析】
恒温恒压下,同一可逆反应,若投料量转化成相同物质时量是成比例的,达平衡时即为等效平衡,平衡后体系中各组分的百分含量相同,各组分的浓度相同;所以题中两个反应为等效平衡,达到平衡时反应物的转化率相等,则反应放出的热量关系为:a1=2a2;再根据可逆反应特点得出:197kJ>a1=2a2.
恒温恒压下,对于可逆反应2SO2(g)+O2(g)![]() 2SO3(g),向恒压密闭容器中通入2molSO2和1mol O2与只通入1molSO2和0.5molO2互为等效平衡,达到平衡时反应物的转化率一定相等,则反应放出的热量关系为:a1=2a2;
2SO3(g),向恒压密闭容器中通入2molSO2和1mol O2与只通入1molSO2和0.5molO2互为等效平衡,达到平衡时反应物的转化率一定相等,则反应放出的热量关系为:a1=2a2;
在可逆反应的热化学方程式中,反应热是指完全转化的反应热,所以a1<197kJ,
即:197kJ>a1=2a2,
故选:D。


科目:高中化学 来源: 题型:
【题目】氮气是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义。
(1)合成氨的原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1。
2NH3(g) ΔH=-92.4kJ·mol-1。
①将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下达到平衡,平衡时测得N2为0.1mol,H2为0.4mol,NH3为0.1mol。该条件下H2的转化率为__。此温度下该反应的平衡常数K=___。
②欲提高H2的转化率,下列措施可行的是___。
a.向容器中按原比例再充入原料气
b.向容器中再充入惰性气体
c.改变反应的催化剂
d.液化生成物分离出氨
(2)在2L密闭容器中,800℃时反应2NO(g)+O2(g)![]() 2NO2(g) ΔH<0体系中,各成分物质的量随时间的变化如图所示。
2NO2(g) ΔH<0体系中,各成分物质的量随时间的变化如图所示。

①用O2表示0~2s内该反应的平均速率v=___。
②能说明该反应已经达到平衡状态的是___。
a.容器内压强保持不变
b.2v(NO2)=v(O2)
c.v逆(NO)=2v正(O2)
d.容器内物质的密度保持不变
③能使该反应的反应速率增大,且平衡向正反应方向移动的是__。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.将容器的体积缩小至1L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向盛有少量苯酚稀溶液的试管中逐滴加入饱和溴水,产生白色沉淀 | 苯酚与Br2反应生成2,4,6三溴苯酚 |
B | 向H2O2溶液中滴入NaClO溶液,产生无色气体 | H2O2具有氧化性 |
C | 向FeCl3溶液中滴入少量KI溶液,再加入KSCN溶液,溶液变红 | Fe3+与I-的反应具有可逆性 |
D | 向蔗糖中滴加少量浓硫酸,搅拌,蔗糖变黑,体积膨松,变成疏松多孔的海绵状 | 浓硫酸具有脱水性和氧化性 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茉莉酸甲酯的一种合成路线如下:

(1) C中含氧官能团名称为________。
(2) D→E的反应类型为________。
(3) 已知A、B的分子式依次为C6H10O4、C12H18O4,A中不含甲基,写出B的结构简式:________。
(4) D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①分子中含有苯环,能与FeCl3溶液发生显色反应;
②碱性条件水解生成两种产物,酸化后两种分子中均只有3种不同化学环境的氢。
(5) 写出以 和CH2(COOCH3)2为原料制备
和CH2(COOCH3)2为原料制备 的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)_______。
的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将盐酸滴加到Na2X溶液中,混合溶液的pOH[pOH=—lgc(OH-)]与离子浓度变化的关系如图所示。

下列叙述正确的是
A. 曲线N表示pOH与 两者的变化关系
两者的变化关系
B. NaHX溶液中c(X2-)>c(H2X)
C. 当混合溶液呈中性时,c(Na+)=c(HX-)+2c(X2-)
D. 常温下,Na2X的第一步水解常数Kh1=1.0×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质子交换膜燃料电池(PEMFC)常作为电动汽车的动力源。该燃料电池以氢气为燃料,空气为氧化剂,铂作催化剂,导电离子是H+。下列对该燃料电池的描述中正确的是( )
①正极反应为:O2+4H++4e-2H2O
②负极反应为:2H2-4e-4H+
③总的化学反应为:2H2+O2![]() 2H2O
2H2O
④氢离子通过电解质向负极移动
A. ①② B. ②③④ C. ①② ③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在20.0mL0.10molL-1氨水中滴入0.10molL-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10molL-1氨水的电离度为1.32%,下列有关叙述不正确的是( )
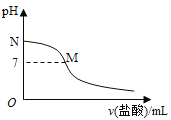
A. 该滴定过程应该选择甲基橙作为指示剂
B. M点对应的盐酸体积大于20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-)
D. N点处的溶液中pH小于12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水体砷污染已成为一个亟待解决的全球性环境问题,我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的正五价砷[As(Ⅴ)],其机制模型如下。

零价铁活化过硫酸钠去除废水中As(Ⅴ)的机制模型
资料:
Ⅰ.酸性条件下SO4·为主要的自由基,中性及弱碱性条件下SO4·和·OH同时存在,强碱性条件下·OH为主要的自由基。
Ⅱ.Fe2+、Fe3+形成氢氧化物沉淀的pH
离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe2+ | 7.04 | 9.08 |
Fe3+ | 1.87 | 3.27 |
(1)砷与磷在元素周期表中位于同一主族,其原子比磷多一个电子层。
① 砷在元素周期表中的位置是______。
② 砷酸的化学式是______,其酸性比H3PO4______(填“强”或“弱”)。
(2)零价铁与过硫酸钠反应,可持续释放Fe2+,Fe2+与S2O82反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As(Ⅴ)去除完全。
①S2O82中S的化合价是______。
②零价铁与过硫酸钠反应的离子方程式是______。
③Fe3+转化为Fe2+的离子方程式是______。
(3)不同pH对As(Ⅴ)去除率的影响如图。5 min内pH = 7和pH = 9时去除率高的原因是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某澄清透明溶液可能含有Na+、Cl-、CO32-、SO42-、Mg2+、NH4+中的几种,进行如下实验:将上述溶液分为两等份,其中一份滴加足量的BaCl2溶液,得到白色沉淀4.66g;另一份溶液中滴加足量的NaOH溶液,得到0.58g白色沉淀,加热后产生标准状况下的气体0.224L,该气体能使湿润的红色石蕊试纸变蓝色。下列说法正确的是( )
A.溶液中可能有Na+、Cl-
B.溶液中一定没有Cl-、CO32-
C.溶液中一定有Na+、SO42-、Mg2+、NH4+
D.溶液中是否存在Na+只能用焰色反应确认
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com