
下列反应的离子方程式正确的是
A.稀硫酸与铁反应:2Fe+6H+=2Fe3++3H2↑
B.2 mol·L-1的AlCl3溶液和7 mol·L-1的NaOH溶液等体积均匀混合:
2Al3++7OH-=Al(OH)3↓+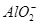 +2H2O
+2H2O
C.Ba(OH)2溶液中加入少量的NaHSO4溶液:
Ba2++2OH-+2H++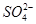 =BaSO4↓+2H2O
=BaSO4↓+2H2O
D.NaHCO3的水【解析】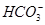 +H2O
+H2O 
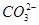 +H3O+
+H3O+
 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)3.2水的电离溶液的酸碱性(解析版) 题型:选择题
水的电离过程为H2O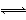 H++OH-,在25 ℃时水的离子积为KW=1.0×10-14,在35 ℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是( )
H++OH-,在25 ℃时水的离子积为KW=1.0×10-14,在35 ℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是( )
A.c(H+)随着温度的升高而降低
B.35 ℃时c(H+)>c(OH-)
C.35 ℃时的水比25 ℃时的水电离程度小
D.水的电离是个吸热过程
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)2.3.3化学平衡常数试卷(解析版) 题型:选择题
高温下,某反应达平衡,平衡常数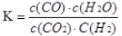 。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO+H2O CO2+H2O
CO2+H2O
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步练(人教选修4)2.3化学平衡状态的建立及标志(解析版) 题型:选择题
在2NO2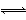 N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
A.N2O4和NO2的分子数比为1∶2
B.N2O4和NO2的浓度相等
C.平衡体系的颜色不再改变
D.单位时间内有1 mol N2O4变为NO2的同时,有2 mol NO2生成
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步练(人教选修4)2.3化学平衡状态的建立及标志(解析版) 题型:选择题
一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A.c1∶c2=3∶1
B.平衡时,Y和Z的生成速率之比为2∶3
C.X、Y的转化率不相等
D.c1的取值范围为0<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学镁、铝及其化合物主要性质(解析版) 题型:选择题
下列实验与对应示意图的关系正确的是
A | B | C | D |
NaAlO2溶液中逐滴滴加盐酸至过量 | AlCl3溶液中逐滴滴加氨水至过量 | 明矾溶液中逐滴滴加Ba(OH)2溶液至过量 | 澄清石灰水中缓慢通入CO2至过量 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学铜及其化合物主要性质、合金(解析版) 题型:选择题
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。用下图装置加热硫酸铜粉末直至完全分解。若硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如下表所示。
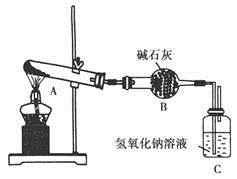
装置 | A(试管+粉末) | B | C |
反应前 | 42.0 g | 75.0 g | 140.0 g |
反应后 | 37.0 g | 79.5 g | 140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是
A.4CuSO4 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
B.3CuSO4 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑
C.5CuSO4 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑
D.6CuSO4 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学钠及其化合物主要性质(解析版) 题型:选择题
将15.6 g Na2O2和5.4 g Al同时放入一定量的水中,充分反应后得到200 mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变,则下列说法正确的是
A.标准状况下,反应过程中得到7.84 L的气体
B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
C.最终得到7.8 g的沉淀
D.最终得到的溶液中c(Na+)=1.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习3(解析版) 题型:填空题
铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
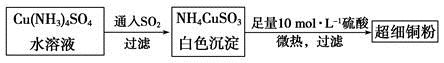
①NH4CuSO3中金属阳离子的核外电子排布式为______。N、O、S三种元素的第一电离能大小顺序为__________________(填元素符号)。
②SO42-的空间构型为________。
(2)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因_________;在该晶体中存在的化学键的种类有_________。
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子的杂化轨道类型为________。已知其中一种化合物的化学式为KCuCl3,则另一种化合物的化学式为____________。

用晶体的X射线衍射法可以测得阿伏加德罗常数的值。对金属铜的测定得到以下结果:铜晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00 g·cm-3,则铜原子的直径约为__________pm,阿伏加德罗常数的值为________[已知Ar(Cu)=63.5]。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com