
科目:高中化学 来源: 题型:
对 Fe、Cl2、Al2O3、SiO2、NaClO、NaAlO2的分类正确的是
A.能与碱反应的物质是Cl2、Al2O3、SiO2
B.能与盐酸反应的物质是Fe、Al2O3、SiO2
C.能与水反应的物质是Fe、Cl2、Al2O3
D.具有两性的物质是Al2O3、SiO2、NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
⑴工业上采用电解氧化铝-冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:
2Al2O3  4Al+3O2↑加入冰晶石的作用:_______________________________。
4Al+3O2↑加入冰晶石的作用:_______________________________。
⑵上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为 ,下列可作阴极材料的是________________。
A.铝材 B.石墨 C.铅板 D.纯铝

⑶阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式为__________________________________。
⑷在铝阳极氧化过程中,需要不断地调整电压,理由是____________ 。
⑸下列说法正确的是 。
A. 阳极氧化是应用原电池原理进行金属材料表面处理的技术
B. 铝的阳极氧化可增强铝表面的绝缘性能
C. 铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D. 铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、N、Q为元素周期表前四周期的六种元素。其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1, Q在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X元素在周期表中的位置是 ,属于 区元素,它的外围电子的电子排布图为 。
(2)XZ2分子的立体结构是 ,YZ2分子中Y的杂化轨道类型为 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 。
(3)含有元素N的盐的焰色反应为 色,
许多金属盐都可以发生焰色反应,其原因是
.
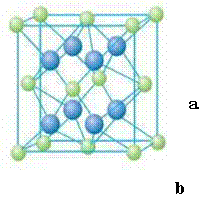
(4)元素M与元素Q形成晶体结构如图所示,
设其晶胞边长为a pm,则a位置与b位置之间的距
离为_______pm(只要求列算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于3.4克氨气的有关说法,正确的是 ( )
A、常温常压下体积为4.48L
B、含有0.1mol N 和0.3mol H
C、常温下,所含原子有0.8mol
D、溶解到1L水中,所得溶液物质的量浓度为0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子序数之和为26;Y和Z在同一周期。下列有关推测正确的是( )
A.XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物XZ
B.XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XY
C.XYZ3是一种易溶于水的盐,且Y与Z可形成离子化合物YZ
D.XYZ3是一种离子化合物,且Y与Z可形成离子化合物YZ2
查看答案和解析>>
科目:高中化学 来源: 题型:
高锰酸钾在实验率和工农业生产中有广泛的用途.实验率以二氰化锰为主要原料制备高锰酸钾。其部分流程如下:

(1)第①步加热熔融应在 中进行.而不用瓷坩埚的原因是 (用化学程式表示)。
(2)第④步通入CO2,可以使Mn(片发生反应.生成MnO4—,和MnO3—反应的离子方程式为
。则完成反应时,转化为KMnO4,的KMnO4,占全部K2MnO4,的百分率约为
(精确到0.1%)。
(3)第⑤步趁热过滤的是 。
(4)第⑥步加热浓缩至液面有细小品体析出时.停止加热.冷却结品、 、洗涤、干燥。干燥过程中.温度不宜过高.其原因是 (用化学方程式表示)。
(5)H2O2和KMnO4,都是常用的强氰化剂。若向H2O2溶液中滴加酸性高锰酸钾溶液.则酸性高锰酸钾溶液会褪色.写出该反应的离子方程式: .该反应说明H2O2的氰化性比KMnO4, (填“强”或“弱”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com