

 ,X的化学式为Fe3C.
,X的化学式为Fe3C.分析 由图中过程可知,磁性氧化物(固体1)为Fe3O4,溶液甲中含FeCl3、FeCl2,加足量氯气氧化亚铁离子,则溶液乙中含FeCl3,固体2为Fe2O3,n(Fe)=$\frac{24.0g}{160g/mol}$×2=0.3mol,即X中含Fe为0.3mol×56g/mol=16.8g;
无色无味气体与石灰水反应生成白色沉淀,则白色沉淀为碳酸钙,X中含C元素,m(C)=18.0g-16.8g=1.2g,n(C)=$\frac{1.2g}{12g/mol}$=0.1mol,则X中Fe、C的物质的量比为0.3mol:0.1mol=3:1,即X的化学式为Fe3C,以此来解答.
解答 解:(1)无色无味气体为CO2,其电子式为 ;由上述分析可知X的化学式为Fe3C,故答案为:
;由上述分析可知X的化学式为Fe3C,故答案为: ;Fe3C;
;Fe3C;
(2)溶液甲与足量氯气反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)化合物X在空气中高温煅烧化学方程式为Fe3C+3O2$\frac{\underline{\;高温\;}}{\;}$Fe3O4+CO2,故答案为:Fe3C+3O2$\frac{\underline{\;高温\;}}{\;}$Fe3O4+CO2.
点评 本题考查无机物的推断,为高频考点,把握磁性氧化物及二氧化碳使石灰水变浑浊为解答该题的关键,侧重分析与推断能力的考查,注意铁离子性质及含Fe氧化物为推断的突破口,题目难度不大.


科目:高中化学 来源: 题型:解答题
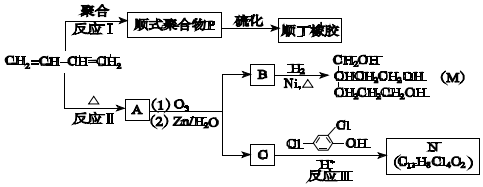
 +
+ $\stackrel{△}{→}$
$\stackrel{△}{→}$
 ;
;


 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物共有5种 | |
| B. | 菲的结构简式如图 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 | |
| C. | 与 互为同分异构体的芳香族化合物有6种 互为同分异构体的芳香族化合物有6种 | |
| D. | 某饱和链烃,分子中含有5个碳原子的,其一氯取代物共有8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
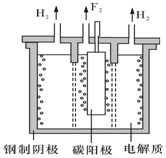 氟是自然界中广泛分布的元素之一.由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异.
氟是自然界中广泛分布的元素之一.由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | HCOOH | HCN | H2S |
| 电离平衡常数(25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
| A. | NaHS溶液中加入适量KOH后:c(Na+)═c(H2S)+c(HS-)+2C(S2-) | |
| B. | HCOO-、CN-、HS-在溶液中不可以大量共存 | |
| C. | 等体积、等浓度的HCOONa和NaCN两溶液中所含离子数目前者大于后者 | |
| D. | 恰好中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若平衡时两容器中的压强不相等,则两容器中压强之比为8:5 | |
| B. | 若平衡时,甲、乙两容器中A的物质的量相等,则x=2 | |
| C. | 若平衡时,甲、乙两容器中A的物质的量不相等,则x=3 | |
| D. | 若平衡时,甲、乙两容器中A的物质的量相等,改为按不同配比作为乙的起始物质,达到平衡后,C的体积分数都仍为0.2.反应从逆反应方向开始,则D的起始物质的量应满足的条件是n(D)>$\frac{4}{3}$ mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同 | |
| B. | 用50 mL 0.50 mol/L盐酸和50 mL 0.55 mol/L NaOH进行实验比用 50 mL 0.50 mol/L盐酸和50 mL 0.50 mol/L NaOH测得的数值准确 | |
| C. | 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 | |
| D. | 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com