
| ||
| (i)R′CHO |
| (ii)H2O/H+ |
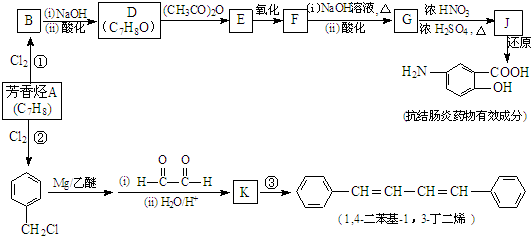
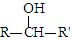 (R、R′表示烃基)
(R、R′表示烃基)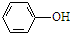
| (CH3CO)2O |
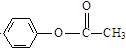
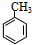 ,与氯气在光照条件下发生取代反应生成
,与氯气在光照条件下发生取代反应生成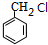 ,
, 发生信息Ⅰ中反应生成K为
发生信息Ⅰ中反应生成K为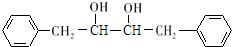 ;由
;由 逆推可知J为
逆推可知J为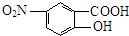 ,G为
,G为 ,D发生信息Ⅱ中的反应得到E,E氧化得到F,F酸化得到G,D→E的转化目的防止酚羟基被氧化,则E为
,D发生信息Ⅱ中的反应得到E,E氧化得到F,F酸化得到G,D→E的转化目的防止酚羟基被氧化,则E为 ,F为
,F为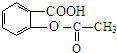 ,则D为
,则D为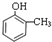 ,B为
,B为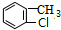 ,据此解答.
,据此解答. ,与氯气在光照条件下发生取代反应生成
,与氯气在光照条件下发生取代反应生成 ,
, 发生信息Ⅰ中反应生成K为
发生信息Ⅰ中反应生成K为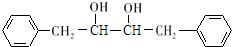 ;由
;由 逆推可知J为
逆推可知J为 ,G为
,G为 ,D发生信息Ⅱ中的反应得到E,E氧化得到F,F酸化得到G,D→E的转化目的防止酚羟基被氧化,则E为
,D发生信息Ⅱ中的反应得到E,E氧化得到F,F酸化得到G,D→E的转化目的防止酚羟基被氧化,则E为 ,F为
,F为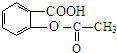 ,则D为
,则D为 ,B为
,B为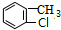 ,
, 与氯气在光照条件下发生取代反应生成
与氯气在光照条件下发生取代反应生成 ,G中苯环是H原子为硝基取代生成J,属于取代反应,故答案为:光照;取代反应;
,G中苯环是H原子为硝基取代生成J,属于取代反应,故答案为:光照;取代反应;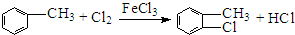 ,故答案为:
,故答案为: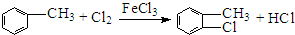 ;
;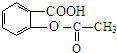 ,故答案为:
,故答案为: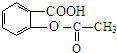 ;
;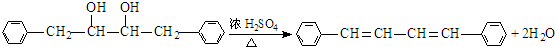 ,
,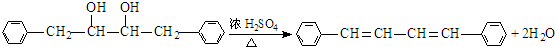 ;
; ,
, .
.


 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
| A、铂做电极,以KOH溶液为电解质溶液的肼--空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2+4H2O | ||||
B、燃煤中加入生灰石可以减少SO2的排放:O2+2CaO+2SO2
| ||||
| C、用氢氟酸蚀刻玻璃:SiO2+4HF=SiF4↑+2H2O | ||||
| D、将明矾放入浑浊的河水中,可使水澄清:Al3++3H2O=Al(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 预期现象 | 结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
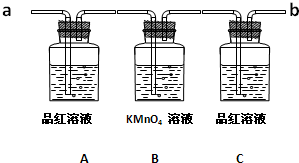
查看答案和解析>>
科目:高中化学 来源: 题型:
 四种强电解质A、B、C、D的溶液,分别含有下列阴阳离子的各一种,且不重复.已知A溶液为黄色,含0.01mol的A溶液与含0.01mol的B溶液反应生成白色沉淀,再逐滴加入D溶液,白色沉淀最后转变为黄色沉淀.将C溶液滴在pH试纸的中部,显蓝色.
四种强电解质A、B、C、D的溶液,分别含有下列阴阳离子的各一种,且不重复.已知A溶液为黄色,含0.01mol的A溶液与含0.01mol的B溶液反应生成白色沉淀,再逐滴加入D溶液,白色沉淀最后转变为黄色沉淀.将C溶液滴在pH试纸的中部,显蓝色.| 阳离子 | K+、Fe3+、Ag+、Ca2+ |
| 阴离子 | Cl-、I-、CO32-、NO-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
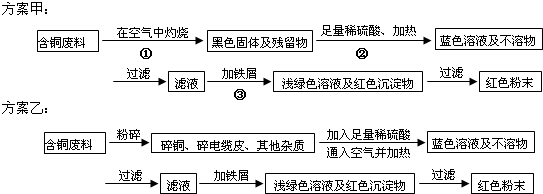
查看答案和解析>>
科目:高中化学 来源: 题型:
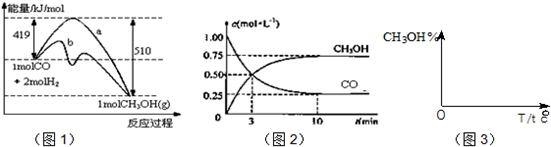
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一部分为Al(OH)3,一部分为Al3+ |
| B、全部为Al(OH)3 |
| C、一部分为Al(OH)3,一部分为AlO2- |
| D、全部为AlO2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com