
| A. | 等体积、等浓度的KHSO4溶液与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 在次氯酸中加入碳酸钠:2HClO+CO32-═2ClO-+H2O+CO2↑ | |
| C. | 钾与水反应:2K+2H2O═2K++2OH-+H2↑ | |
| D. | 氯化钠溶液中通入氟气:F2+2Cl-═2F-+Cl2↑ |
分析 A.等体积、等浓度的KHSO4溶液与Ba(OH)2溶液反应生成硫酸钡、氢氧化钠和水;
B.不符合反应客观事实;
C.二者反应生成氢氧化钾和氢气;
D.不符合反应客观事实,氟气通入氯化钠溶液与水反应生成氢氟酸和氧气.
解答 解:A.等体积、等浓度的KHSO4溶液与Ba(OH)2溶液反应,离子方程式:Ba2++OH-+H++SO42-═BaSO4↓+H2O
,故A错误;
B.在次氯酸中加入碳酸钠生成次氯酸钠和碳酸氢钠,离子方程式:HClO+CO32-═ClO-+HCO3-,故B错误;
C.钾与水反应,离子方程式:2K+2H2O═2K++2OH-+H2↑,故C正确;
D.氯化钠溶液中通入氟气,离子方程式:2F2+2H2O═4HF+O2↑,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应遵循原子个数守恒规律,题目难度不大.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:多选题
| A. | 28g乙烯所含共用电子对数目为4NA | |
| B. | 1 mol甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.5 mol1,3-丁二烯分子中含有C=C双键数为NA | |
| D. | 标准状况下,11.2 L己烷所含分子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
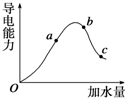 在25℃时,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
在25℃时,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 滴定过程中总是存在:Ka>Kh | |
| B. | 点②所示溶液中存在:c(Na+)=c(A-) | |
| C. | 点③所示溶液中存在:c(Na+)=c(A-)+c(HA) | |
| D. | 向点①所示溶液中加水:$\frac{c({A}^{-})}{c(O{H}^{-})•c(HA)}$比值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上适应性考试二化学试卷(解析版) 题型:填空题
[化学—选修2:化学与技术]
工业炼铜的方法有由黄铜矿(主要成分是CuFeS2,杂质不含铜元素)炼制精铜的工艺流程示意图如图:
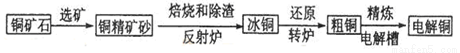
(1).黄铜矿中铜的质量分数为0.4,生产1吨纯铜理论上需要这种黄铜矿____________吨。
(2).在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,_____________________。且部分Fe的硫化物转变为Fe的低价氧化物。
(3).从环保环境和充分利于原料角度看如何处理和利用产生的烟气?___________。
(4).在转炉中,冰铜中的Cu2S先被氧化成Cu2O,,生成的Cu2O再与Cu2S反应,两步反应的热化学方程式为:①2Cu2S(s)+3O2(g)═2Cu2O(s))+2SO2(g)△H=-768.2kJ.mol-1
②2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJ.mol-1
则反应Cu2S转化为铜的热化学方程式:_________________________。
将3molCu2S与一定量的空气(氮气、氧气的体积比为4:1)在密闭容器中充分反应(假设各步反应都完全且Cu2S完全参与反应),得到单质铜3mol,所得气体中SO2的体积分数为_____________。
(5).电解精炼铜,电解质溶液为______________,电解一段时间后,电解质溶液的浓度_____________(填“减少”、“不变”、或“增大”)
(6).利于反应Cu+H2O2+H2SO4=CuSO4+2H2O可以制备CuSO4,若将该反应设计为原电池,其正极电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源:2017届山西大学附中高三上10月模块诊断化学试卷(解析版) 题型:填空题
I.我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。已知:
2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol
2Fe(s)+3/2O2(g)=Fe2O3(s) △H=-825.5 kJ/mol
(1)请回答:反应:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H= kJ/mol。
2Fe(s)+3CO2(g) △H= kJ/mol。
II.已知反应1/3Fe2O3(s)+CO(g) 2/3Fe(s)+CO2(g)在1000℃的平衡常数K等于4.0 ,在一个容积为10L的密闭容器中,1000℃时加入Fe、F
2/3Fe(s)+CO2(g)在1000℃的平衡常数K等于4.0 ,在一个容积为10L的密闭容器中,1000℃时加入Fe、F e2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
e2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
(2)该反应的平衡常数表达式为K=____________;CO的平衡转化率= _____________。
(3)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
III. 以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
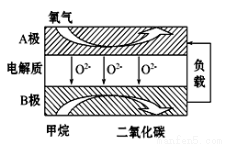
(4)B极上的电极反应式为 。
(5)若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当阳极收集到11.2L(标准状况)气体时,消耗甲烷的体积为 L(标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com