
【题目】(1)硝基苯甲酸乙酯在OH-存在下发生水解反应:O2NC6H4COOC2H5+OH-O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.050 mol·L-1,15℃时测得O2NC6H4COOC2H5的浓度c随时间变化的数据如下表所示。回答下列问题:
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
c/mol/L | 0.050 | 0.036 | 0.030 | 0.026 | 0.022 | 0.017 | 0.016 | 0.015 | 0.015 |
计算该反应在120~180s间的平均反应速率v(OH-)=_________;比较120~180s与180~240 s 区间的平均反应速率的大小,前者___________后者(填>,<或=),理由是:____________。
(2)某研究小组在实验室将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,温度恒定,固体试样体积忽略不计),t1时刻,反应:NH2COONH4(s)2NH3(g)+CO2(g)达到分解平衡。请在图中画出容器内NH3和CO2的物质的量浓度随时间变化的趋势图:_________
(3)工业上合成尿素的反应为:2NH3(g)+CO2(g)CO(NH2)2(s) +H2O(g) 。在一定温度和压强下,往容积可变的密闭容器内通入物质的量各为1mol的氨气和二氧化碳发生上述反应。下列说法中能说明该反应一定达到化学平衡的是_______________。
A.断裂amol的N—H键的同时消耗a/2 mol的尿素
B.密闭容器中二氧化碳的体积分数保持不变
C.密闭容器中混合气体的密度保持不变
D.密闭容器中混合气体的平均摩尔质量保持不变
【答案】104 mol·L1·s1 > 反应物浓度降低,反应速率减慢  CD
CD
【解析】
(1)先计算120~180s间O2NC6H4COOC2H5的浓度改变量,再计算120~180s间OH-的浓度改变量,再计算速率;分别计算出120~180s 和180~240 s O2NC6H4COOC2H5的改变量,根据改变量得出反应速率。
(2)根据NH2COONH4(s)2NH3(g)+CO2(g),生成的两种气体物质的量之比始终为2:1。
(3)A.断裂amol的N—H键,正向反应,同时消耗![]() mol的尿素,逆向反应,消耗速率比不等于计量系数比,不能说明达到平衡;B. 容积可变,密闭容器中二氧化碳的体积分数保持不变,不能说明达到化学平衡;C. 密度等于气体质量除以容器体积,气体质量减少,容器体积也减少,两者减少程度不相同,当密闭容器中混合气体的密度保持不变,则达到平衡;D. 摩尔质量等于气体质量除以气体物质的量,气体质量减少,气体物质的量减少,当密闭容器中混合气体的平均摩尔质量保持不变,则达到平衡。
mol的尿素,逆向反应,消耗速率比不等于计量系数比,不能说明达到平衡;B. 容积可变,密闭容器中二氧化碳的体积分数保持不变,不能说明达到化学平衡;C. 密度等于气体质量除以容器体积,气体质量减少,容器体积也减少,两者减少程度不相同,当密闭容器中混合气体的密度保持不变,则达到平衡;D. 摩尔质量等于气体质量除以气体物质的量,气体质量减少,气体物质的量减少,当密闭容器中混合气体的平均摩尔质量保持不变,则达到平衡。
(1)120~180s间O2NC6H4COOC2H5的浓度改变量为0.006 mol·L1,则OH-的浓度改变量为0.006 mol·L1,该反应在120~180s间的平均反应速率![]() ;120~180s O2NC6H4COOC2H5的改变量为0.006 mol·L1,180~240 s O2NC6H4COOC2H5的改变量为0.004 mol·L1,时间相同,前者改变量大,因此前者的平均反应速率的大;故答案为:>;反应物浓度降低,反应速率减慢。
;120~180s O2NC6H4COOC2H5的改变量为0.006 mol·L1,180~240 s O2NC6H4COOC2H5的改变量为0.004 mol·L1,时间相同,前者改变量大,因此前者的平均反应速率的大;故答案为:>;反应物浓度降低,反应速率减慢。
(2)根据NH2COONH4(s)2NH3(g)+CO2(g),生成的两种气体物质的量之比始终为2:1,t1时刻,反应:NH2COONH4(s)2NH3(g)+CO2(g)达到分解平衡。容器内NH3和CO2的物质的量浓度随时间变化的趋势图为 ;故答案为:
;故答案为: 。
。
(3)工业上合成尿素的反应为:2NH3(g)+CO2(g)CO(NH2)2(s) +H2O(g) 。在一定温度和压强下,往容积可变的密闭容器内通入物质的量各为1mol的氨气和二氧化碳发生上述反应。下列说法中能说明该反应一定达到化学平衡的是_______________。
A.断裂amol的N—H键,正向反应,同时消耗![]() mol的尿素,逆向反应,消耗速率比不等于计量系数比,不能说明达到平衡,故A不符合题意;B.由于恒温恒压容积可变,通入物质的量各为1mol的氨气和二氧化碳,密闭容器中二氧化碳的体积分数始终保持不变(50%),不能判断达到化学平衡,故B符合题意;C. 密度等于气体质量除以容器体积,气体质量减少,容器体积也减少,两者减少程度不相同,当密闭容器中混合气体的密度保持不变,则达到平衡,故C符合题意;D. 摩尔质量等于气体质量除以气体物质的量,气体质量减少,气体物质的量减少,当密闭容器中混合气体的平均摩尔质量保持不变,则达到平衡,故D符合题意;综上所述,答案为:CD。
mol的尿素,逆向反应,消耗速率比不等于计量系数比,不能说明达到平衡,故A不符合题意;B.由于恒温恒压容积可变,通入物质的量各为1mol的氨气和二氧化碳,密闭容器中二氧化碳的体积分数始终保持不变(50%),不能判断达到化学平衡,故B符合题意;C. 密度等于气体质量除以容器体积,气体质量减少,容器体积也减少,两者减少程度不相同,当密闭容器中混合气体的密度保持不变,则达到平衡,故C符合题意;D. 摩尔质量等于气体质量除以气体物质的量,气体质量减少,气体物质的量减少,当密闭容器中混合气体的平均摩尔质量保持不变,则达到平衡,故D符合题意;综上所述,答案为:CD。


科目:高中化学 来源: 题型:
【题目】己知:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。向恒容密闭容器中充入0.lmolCH4和0.2molH2S,如图所示:
CS2(g)+4H2(g)。向恒容密闭容器中充入0.lmolCH4和0.2molH2S,如图所示:
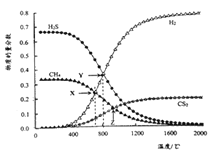
下列说法不正确的是
A.该反应的△H>0
B.X点CH4的转化率为20%
C.X点与Y点容器内压强比为55:51
D.维持Z点温度,向容器中再充入CH4、H2S、CS2、H2各0.1mol时v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各题
(1)工业上制取粗硅的化学反应方程式_________________
(2)实验室用氯气制取少量“84”消毒液方程式________________
(3)铜和浓硫酸化学反应方程式_________________
(4)二氧化硅与氢氧化钠溶液反应的离子方程式_________________
(5)用电子式表示氯化镁的形成过程__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2 2NO + O2 (NO2为红棕色气体,其余气体无色)在恒温恒容密闭容器中进行,达到限度的标志是
① 单位时间内生成n mol O2的同时生成2n mol NO2
② v正(NO)=v逆(O2)
③ 混合气体的平均相对分子质量不再改变的状态
④ 混合气体的颜色不再改变的状态
⑤ 混合气体的密度不再改变的状态
⑥ 混合气体的压强不再改变的状态
⑦ 用NO2与NO、O2表示的反应速率之比为2:2:1的状态
A.①③④⑥B.②③⑤⑦C.①③④⑤D.①②⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的强氧化剂,工业上常用铬铁矿(主要成分是亚铬酸亚铁Fe(CrO2)2,还有硅、铝等杂质)为主要原料生产重铬酸钾(K2Cr2O7),主要工艺流程如图:

(1)步骤①中主要反应的化学方程式___。
(2)步骤③中沉淀是___(填化学式)
(3)步骤④中反应的离子方程式为___。
(4)有关物质的溶解度如图所示。
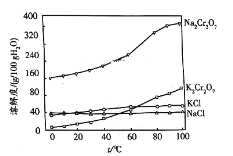
步骤⑤加氯化钾固体后的具体实验操作为___。经洗涤、干燥得到K2Cr2O7晶体样品,得到的样品中含有少量的NaCl等杂质,洗涤晶体适宜选用的试剂为___。
a.冷水 b.75%乙醇 c.四氯化碳
(5)向一支试管中加入H2O2溶液、乙醚、稀硫酸溶液和几滴K2Cr2O7溶液,经反应后发现上层为蓝色的CrO5乙醚溶液。CrO5中铬的化合价为+6价,求-2价和-1价氧的个数比为___,一段时间后,蓝色逐渐消失,其反应的离子方程式为4CrO5+12H+=4Cr3++7O2↑+6H2O,消耗1mol的CrO5转移电子的物质的量为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物Q的相对分子质量为148,Q既能使溴的四氯化碳溶液褪色,又能与小苏打反应放出气体。下列有关Q的叙述错误的是
A. 分子式为C9H8O2 B. 发生酯化反应
C. 结构简式有5种 D. 分子中所有原子不能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作对应的现象不符合事实的是
|
|
|
|
A.少量二氧化硫通入氯化钡溶液中,产生白色沉淀亚硫酸钡 | B.在新制Cu(OH)2悬浊液中加入少量的葡萄糖,加热,产生砖红色沉淀 | C.将少量钠投入到无水乙醇中,钠表面有气泡产生 | D.在盛水的烧杯中加入氯化钠固体,小灯泡会逐渐亮起来 |
A. AB. BC. C...D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为探究SO2的性质,设计如图所示实验装置(装置中的固定仪器和酒精灯均未画出):请回答下列问题:
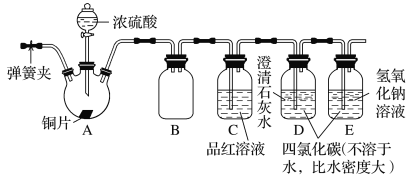
(1)B装置与D、E两装置中四氯化碳(CCl4)的作用相同,其作用是___。
(2)C装置中的现象是___,该现象证明SO2具有__性。
(3)若将C装置中的试剂换成酸性KMnO4溶液,发生反应的离子方程式为__,证明SO2具有__性。
(4)若将C装置中的试剂换成Na2S溶液,则现象为__,证明SO2具有___性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多巴胺是一种神经传导物质,在大脑内传递兴奋的信息,其分子结构如下所示。下列关于多巴胺的说法不正确的是

A. 分子式为C8H11NO2
B. 能与醛类物质发生缩聚反应
C. 既能与酸反应,又能与碱反应
D. 1mol该物质最多能与2mol Br2发生取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com