
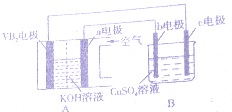
 碱性硼化钒(VB2),-空气电池工作时反应为:4VB2+1lO2=4B203+2V205.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到 0.448L气体(标推状况)下列说法正确的是( )
碱性硼化钒(VB2),-空气电池工作时反应为:4VB2+1lO2=4B203+2V205.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到 0.448L气体(标推状况)下列说法正确的是( )| A. | VB2电极发生的电极反应为:2VB2+11H20-22e-═V205+2B203+22H+ | |
| B. | 若B装置内液体的体积一直为200mL,则原CuS04溶液浓度为0.05 mol/L | |
| C. | 电解过程中,b电极表面先有红色物质析出,然后有气泡产生 | |
| D. | 外电路中电子由c电极流向VB2电极 |
分析 硼化钒-空气燃料电池中,VB2在负极失电子,氧气在正极上得电子,电池总反应为:4VB2+11O2═4B2O3+2V2O5,则与负极相连的c为电解池的阴极,铜离子得电子发生还原反应,与氧气相连的b为阳极,氢氧根失电子发生氧化反应,以此解答该题.
解答 解:A.负极上是VB2失电子发生氧化反应,则VB2极发生的电极反应为:2VB2+22OH--22e-=V2O5+2B2O3+11H2O,故A错误;
B.外电路中通过0.04mol电子时,B装置内与氧气相连的b为阳极,氢氧根失电子生成氧气为0.01mol,又共收集到0.448L气体即$\frac{0.448L}{22.4L/mol}$=0.02mol,则阴极也产生0.01moL的氢气,所以溶液中的铜离子为$\frac{0.04-0.01×2}{2}$=0.01mol,则CuSO4溶液的物质的量浓度为$\frac{0.01mol}{0.2L}$=0.05mol/L,故B正确;
C.电解过程中,c为阴极,发生还原反应,先生成铜,后生成氢气,故C错误;
D.外电路中电子由VB2电极流向阴极c电极,故D错误;
故选:B.
点评 本题考查原电池及其电解池的工作原理,注意离子的放电顺序,侧重于学生的分析、计算能力的考查,题目难度不大,本题注意把握电极反应式的书写,利用电子守恒计算.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA | |
| B. | 20g重水中含有的电子数为10NA | |
| C. | 常温下,5.6g铁与足量的盐酸反应,失去的电子数为0.3NA | |
| D. | 1L 0.1mol/L NH4Cl溶液中含NH4+数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3、KClO3与单质S、C2H5OH不能混搭存放在同一库房间 | |
| B. | 缺铁性补血服用补铁剂时,需与维C同时服用 | |
| C. | 铜制品、铁制品在潮湿的空气中生锈 | |
| D. | 用乙醚从黄花蒿中提取青蒿素 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
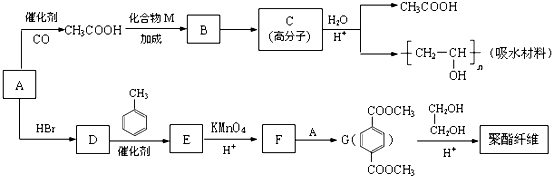
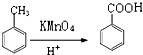
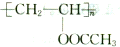 ,D→E的反应类型是取代反应.
,D→E的反应类型是取代反应. .
.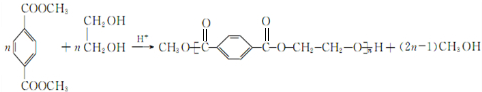 .
. (写结构简式)
(写结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
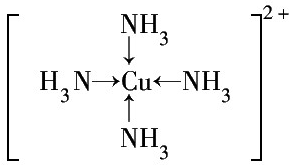 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
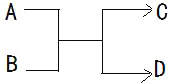
| A. | 若 A 为铁,D 为氢气,则 B 一定为酸 | |
| B. | 若 A、D 为化合物,B 为水,则 C 一定是气体单质 | |
| C. | 若 A、B、C、D 均为化合物,该反应一定属于复分解反应 | |
| D. | 若 A、B、C、D 均为 10 电子微粒,且 C 是可使湿润的红色石蕊试纸变蓝的气体,则 D 常温下一定呈液态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(B)>r(C)>r(D) | |
| B. | C的最高价氧化物对应水化物的碱性在同周期中最强 | |
| C. | E分别与A、C形成的化合物中化学键类型相同 | |
| D. | B的简单气态氢化物的热稳定性比D的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向上述NaOH溶液中通入SO2:2OH-+SO2═SO32-+H2O | |
| B. | 上述反应后所得溶液的PH约为12:SO32-+H2O?HSO3-+OH- | |
| C. | 向上述反应后所得溶液中通入氯气,PH下降:SO32-+Cl2+2OH-═SO42-+2Cl-+H2O | |
| D. | 向上述反应后所得溶液中滴加少量H2O2和BaCl2溶液的混合液,产生白色沉淀:SO32-+Ba2++H2O2═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
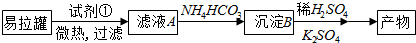
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com