
 选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置(只有两个电极),观察到电流计G的指针均明显偏转,则其可能的组合共有( )
选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置(只有两个电极),观察到电流计G的指针均明显偏转,则其可能的组合共有( )| A、6种 | B、5种 | C、4种 | D、3种 |


科目:高中化学 来源: 题型:
| 元素符号 | X | Y | Z | M | N |
| 原子半径(nm) | 0.160 | 0.111 | 0.104 | 0.143 | 0.066 |
| 主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
| A、单质与稀硫酸反应的速率快慢:M>Y>X |
| B、元素Z和N的质子数相差6 |
| C、元素Y和Z可能同周期 |
| D、相同条件下,等物质的量的单质与氢气化合放出能量的多少:N>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+ )+c(H+)═c(CH3COO- )+c(OH- ) |
| B、c(OH- )═c(H+ )+c(CH3COOH) |
| C、c(Na+ )=c(CH3COO- )+c(CH3COOH) |
| D、c(Na+ )>c(CH3COO- )>c(H+ )>c(OH- ) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+ H+ Fe2+ NO3- |
| B、H+ Al3+ SO42- Cl- |
| C、Na+ Al3+ HCO3- Cl- |
| D、Na+ NH4+ OH- CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
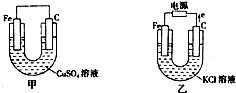 根据如图所提供的信息,在反应一段时间后:
根据如图所提供的信息,在反应一段时间后:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液的pH变大 |
| B、c(Na+)与c(CO32-)的比值变大 |
| C、溶液浓度变大,有晶体析出 |
| D、实质是电解水,有晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度,溶液的pH降低 |
| B、c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| C、加入少量NaOH固体,c(CO32-)与c(Na+)均增大 |
| D、c(Na+)+c(H+)=2c(CO32-)+2c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
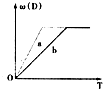 已知下列化学反应:3A(g)+B(g)?C(s)+4D(g)△H<0中a、b分别表示在一定条件下D的体积分数[ω(D)]随反应时间T的变化情况.若使曲线b变为曲线a,可采用的措施是( )
已知下列化学反应:3A(g)+B(g)?C(s)+4D(g)△H<0中a、b分别表示在一定条件下D的体积分数[ω(D)]随反应时间T的变化情况.若使曲线b变为曲线a,可采用的措施是( )| A、增大B的浓度 |
| B、升高温度 |
| C、缩小容器体积 |
| D、降低温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com