
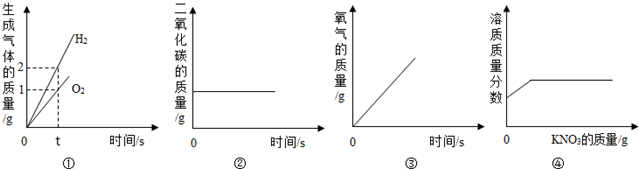
| A. | ①水的电解 | |
| B. | ②木炭在密闭的容器内燃烧 | |
| C. | ③加热一定量的高锰酸钾制氧气 | |
| D. | ④20℃时,向一定量接近饱和的硝酸钾溶液中加入硝酸钾固体 |
分析 可以根据图中的信息进行分析、判断,从而得出正确的结论.
A.①通电分解水时产生氢气的体积是氧气的二倍;
B.②木炭在密闭的容器内燃烧,二氧化碳量在增加;
C.③加热一定量的高锰酸钾制氧气,高锰酸钾完全反应,无氧气增加;
D.接近饱和的硝酸钾溶液中可继续溶解硝酸钾固体直至饱和.
解答 解:A.电解水时生成的氢气和氧气的体积比是2:1,图中是质量比,故A错误;
B.木炭在密闭的容器内燃烧时二氧化碳的质量应该是增加的,故B错误;
C.加热一定量的高锰酸钾制氧气时氧气的质量是不断增加的,当高锰酸钾完全反应后氧气的质量不再增加,故C错误;
D.20℃时,向一定量接近饱和的硝酸钾溶液中加入硝酸钾固体时还能溶解一部分硝酸钾,当达到饱和时不再溶解硝酸钾,故D正确.
故选D.
点评 本题考查化学反应与图象知识的关系,解答本题要把图中提供的信息和所学知识有机的结合起来,结合反应的过程与图象情况的走势联系起来是解题的关键所在,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | HCO3-的水解程度大于电离程度 | B. | HCO3-的水解程度小于电离程度 | ||
| C. | HCO3-的水解程度等于电离程度 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
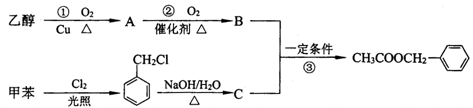
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
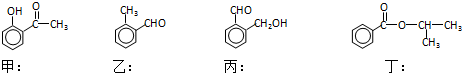
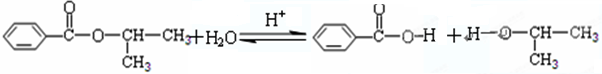 ;
;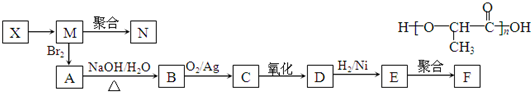
 .
.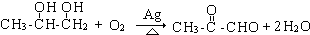 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
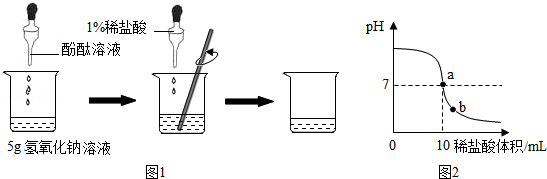
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | 水分子的比例模型: | ||
| C. | 硅的原子结构示意图: | D. | Na2S的电子式 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com