
| 1000ρω |
| M |
| m |
| ρ |
| n |
| V |
| 1000ρω |
| M |
| 1000×1.84×98% |
| 98 |
| 584g |
| 1.46g/mL |
| 100mL×18.4mol/L |
| 400mL |


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
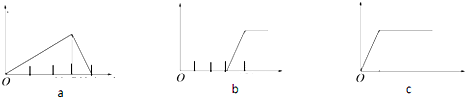
| A、(1)和a |
| B、(2)和a |
| C、(3)和c |
| D、(4)和b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=7的溶液一定呈中性 |
| B、同温时,溶液pH相差3,则c(H+)相差3倍 |
| C、pH=6的HCl加水稀释1000倍后,溶液呈碱性 |
| D、同温时,pH=5的CH3COOH溶液酸性比pH=6的盐酸的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱性:NaOH<Mg(OH)2<Al(OH)3 |
| B、第一电离能:Na<Al<Mg |
| C、电负性:Na>Mg>Al |
| D、原子半径:Na<Mg<Al |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“雨后彩虹”、“海市蜃楼”都与胶体的光学现象有关 |
| B、硫酸钡在医疗上可用作检杳肠胃的内服药剂,俗称“钡餐” |
| C、工业制取硫酸的设备依次是沸腾炉、接触室、吸收塔 |
| D、向某无色溶液中加入BaC12溶液有白色沉淀出现,再加入稀盐酸,沉淀不消失,则该溶液中一定含有S042- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
| B、正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 |
| C、正反应速率均增大,平衡向正反应方向移动 |
| D、正逆反应速率均减小,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 温度/℃ | H2O2溶液浓度 | 加入的其它物质 |
| ① | 25 | 5% | -- |
| ② | 50 | 10% | -- |
| ③ | 25 | 5% | MnO2 |
| ④ | 50 | 10% | FeCl3 |
| A、实验①和②可探究温度对该反应速率的影响 |
| B、实验①和②可探究H2O2溶液浓度对该反应速率的影响 |
| C、实验①和③可探究催化剂MnO2对该反应速率的影响 |
| D、实验③和④可比较MnO2和FeCl3两种催化剂对该反应速率的影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com