
| 选项 | 溶液 | 操作及现象 |
| A | BaCl2溶液 | 通入SO2,无明显现象。再通入Cl2,溶液变浑浊。 |
| B | BaCl2溶液 | 通入SO2,无明显现象。再通入NH3,溶液变浑浊。 |
| C | Ca(ClO) 2溶液 | 通入过量CO2,溶液变浑浊。再加入品红溶液,红色褪去。 |
| D | Na[Al(OH)4]溶液 | 通入过量CO2,溶液变浑浊。再加入过量盐酸,浑浊消失,且有气泡产生。 |
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.Na2CO3、NaHCO3被视作“碱”用于面食制作 |
| B.NaHSO4溶液显酸性 |
| C.铝盐可用作净水剂 |
| D.TiCl4溶液经蒸干、焙烧制得TiO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.甲学生:在醋酸钠溶液中滴入2滴酚酞,加热后红色加深,说明盐类水解是吸热反应 |
| B.乙学生:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热反应 |
| C.丙学生:将硝酸铵晶体溶于水,水温下降,说明盐类水解是吸热反应 |
| D.丁学生:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在常温下,Na2SiO3+H2O+CO2 = Na2CO3+H2SiO3↓,说明H2CO3酸性强于H2SiO3; 在高温下, 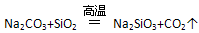 ,说明H2SiO3酸性强于H2CO3 ,说明H2SiO3酸性强于H2CO3 |
| B.c(NH4+)相等的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2溶液,则 c[(NH4)2SO4]>c[(NH4)2CO3] >c[(NH4)2Fe(SO4)2] |
| C.向1L0.3mol/L的NaOH溶液中缓慢通入CO2气体至溶液增重8.8g时,则溶液中 2c(Na+)=3[c(HCO3-)+c(CO32-)+c(H2CO3)] |
| D.在海带中提取碘的实验中既可以用四氯化碳作萃取剂也可以用酒精作萃取剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1 mol/LCH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.室温下,Na2CO3溶液加水稀释后, pH和Kw均减小 |
| C.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 |
| D.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入适量的硫酸溶液,抑制铵根离子的水解 |
| B.加入适量的氨水,使pH值等于7 |
| C.加入适量氢氧化钠,使溶液pH值等于7 |
| D.加入适量硫酸钠,抑制硫酸铵电离 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 合,所得溶液中粒子浓度间的关系及相关判断不正确的是( )
合,所得溶液中粒子浓度间的关系及相关判断不正确的是( )| A.c(Na+)+c(H+)>c(CO32-)+c(HCO3-)+c(OH-) |
| B.c(Na+)>c(CO32-)+c(HCO3-)+c(H2CO3) |
| C.若c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),则一定a<b |
D.若c(CO32-)+2c(OH-)=2c(H+)+c(HCO3-)+3c(H 2CO3),则可确定a=b 2CO3),则可确定a=b |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 弱酸化学式 | CH3COOH | HCN | H2S |
| 电离常数(25 ℃) | 1.8 ×10-5 | 4.9 ×10-10[ | K1="1.3" ×10-7 K2="7.1" ×10-15 |
 S2-)
S2-)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com