
【题目】全钒氧化还原液流电池是一种新型绿色的二次电池。其工作原理如图所示。下列叙述正确的是

A.放电时,电子由Y极流出,经质子交换膜到X极
B.放电过程中,电解质溶液pH降低
C.充电时,X极反应式为:VO2++H2O -e- = VO2++2H+
D.放电时,每转移1 mol电子理论上有2 mol H+由交换膜右侧向左侧迁移
【答案】C
【解析】
观察装置可知,X电极V由+5的VO2+→+4的VO2+,发生得电子的还原反应,即X电极为正极,电极反应式为VO2++e-+2H+=VO2++H2O,Y电极上V2+→V3+,发生失去电子的氧化反应,为负极,电极反应式为V2+-e-=V3+,总反应为V2++VO2++2H+=VO2++V3++H2O,原电池工作时,电子由负极Y经过用电器移向正极X,溶液中的H+由负极Y经过质子交换膜移向正极X,据此分析解答。
A.该原电池中,X电极为正极,Y电极为负极,原电池工作时,电子只能在导线上迁移,即电子由Y极经导线流向X极,故A错误;
B.放电过程中,电池总反应为V2++VO2++2H+=VO2++V3++H2O,消耗了H+,溶液酸性减弱,pH升高,故B错误;
C.充电时,X为阳极,失去电子,发生氧化反应,X极反应式为:VO2++H2O -e- = VO2++2H+,故C正确;
D.X极为正极,电极反应式为VO2++e-+2H+=VO2++H2O,由于得失电子数等于氢离子迁移数目,所以转移1mol电子,只有1mol H+迁移,故D错误;
故选:C。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:
【题目】下列对化学反应方向的说法,正确的是
A.同一物质的固、液、气三种状态的熵值递减
B.常温下反应2Na2SO3(s)+O2(g)=2Na2SO4(s)能自发进行,则△H<0
C.CaCO3(s)=CaO(s)+CO2(g)△H>0,△S>0,不论在何种条件下都不可能自发
D.因为焓变和熵变都与反应的自发性有关,因此焓变或墒变均可以单独做为判断反应能否自发进行的判据
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①正常雨水的pH为7.0,酸雨的pH小于7.0;
②严格执行机动车尾气排放标准有利于防止大气污染;
③使用二氧化硫和某些含硫化合物增白的食品会损害人体健康;
④使用氯气对自来水消毒可能对人体有害;
⑤食品厂产生的含丰富氮、磷营养素的废水可长期排向养鱼水库
⑥人造刚玉熔点很高,可用作高级耐火材料,主要成分是Al2O3
⑦在医疗上碳酸氢钠可用于治疗胃酸过多
⑧分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
A.②③⑤⑥⑦⑧B.①④⑤⑥⑧
C.②③④⑥⑦⑧D.③④⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一容积不变的密闭容器中发生可逆反应:2X(g)![]() Y(g)+Z(s),下列选项能说明该反应达到平衡状态的是( )
Y(g)+Z(s),下列选项能说明该反应达到平衡状态的是( )
A.X的分解速率与Y的分解速率相等
B.X、Y、Z的物质的量之比为2:1:1
C.混合气体的密度不再变化
D.单位时间内生成1molY的同时分解2molx
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氢键既可能存在于分子内,又可能存在于分子间
B.邻羟基苯甲酸的熔点比对羟基苯甲酸的熔点高
C.水结冰体积膨胀,密度减小,水加热到很高温度都难以分解,这都与水分子间形成氢键有关
D.氢键比分子间作用力强,所以它属于化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示两种晶体的微观结构:
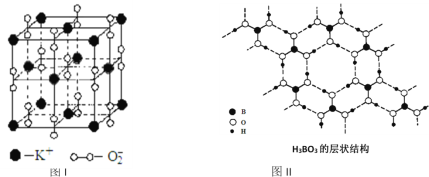
试回答下列有关问题:
(1)高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。图I为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则晶体中,与每个K+距离最近的K+有_________个,0价氧原子与-2价氧原子的数目比为_________;
(2)正硼酸(H3BO3)是一种片层结构的白色晶体,层内的H3BO3分子通过氢键相连(如图II)。下列有关说法正确的有_________。
①正硼酸晶体属于原子晶体
②H3BO3分子的稳定性与氢键有关
③在H3BO3分子中各原子未能都满足8e-稳定结构
④含1molH3BO3的晶体中有3mol氢键
⑤含1molH3BO3的晶体中有3mol极性共价键
⑥晶体中每个B与相邻的3个O共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是( )
A.熔融状态下NaHSO4电离方程式为:NaHSO4(熔融)=Na++HSO![]() 。
。
B.强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子
C.1 mol·L-1的醋酸溶液中c(H+)=0.01 mol·L-1可以证明醋酸是弱电解质
D.HF、HCl、BaSO4都是强电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A.HCl和 NaOH 反应的中和热 H=-57.3kJ·mol-1,则H2SO4 和 Ba(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
B.CO(g)的燃烧热是 283.0kJ·mol-1 则 2CO2(g)=2CO(g)+O2(g)反应的ΔH=+(2×283.0 )kJ·mol-1
C.反应物的总能量低于生成物的总能量时,反应一定不能自发进行
D.一定的温度和一定的压强下,将 0.5molN2 和1.5molH2 置于密闭容器中充分反应,放热19.3kJ,热化学方程式为 N2+3H2![]() 2NH3 ΔH=-38.6kJ·mol-1
2NH3 ΔH=-38.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属和非金属被广泛应用于人类生产生活中。
(1)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用含有小苏打的药品以中和过多的胃酸,其反应的离子方程式:___________________________;
(2)中华透明牙膏摩擦剂SiO2是工业制备晶体硅的原料,工业上制粗硅的反应原理是 __________;(用化学反应方程式表示)。
(3)硅酸钠的水溶液俗称水玻璃,向其中通入过量的CO2,会出现胶状沉淀,其离子方程式是_________;
(4)人体血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化Fe3+而中毒,服用维生素C可以解毒.对上述的分析正确的是(______)
A.亚硝酸盐是还原剂 B.维生素C是氧化剂
C.维生素C被氧化 D.亚硝酸盐发生氧化反应
(5)化学与生产、生活、社会等密切相关,下列说法正确的是(_______)
A. 二氧化硫具有漂白性,可用来增白纸浆、草帽辫、食品等
B. 酸雨是空气中二氧化碳含量超标引起的
C.工业上合成氨气可用浓氨水和生石灰混合制得
D.蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
E.洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,漂白粉是常用的消毒剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com