
| 元素 | 信息 |
| X | K层电子数是L层电子数的2倍 |
| Y | 一种核素在考古时常用来鉴定一些文物的年代 |
| Z | 所处的周期序数与族序数相等 |
| W | 最高价氧化物对应的水化物酸性最强 |
| A、W的阴离子半径大于Z的阳离子半径 |
| B、Y的氢化物比W的氢化物稳定 |
| C、Z的最高价氧化物对应的水化物不能够溶于Y的最高价氧化物对应的水化物 |
| D、X在氧气中加热反应生成X2O2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | |||||||||||||||||
| D | E | F | |||||||||||||||
| B | C | G | H | I | J |
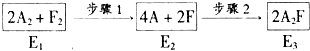
查看答案和解析>>
科目:高中化学 来源: 题型:
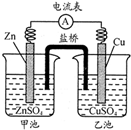 中学教材引入了带盐桥的原电池,该电池即为1806年丹尼尔设计的原电池.如图,下列有关分析正确的是( )
中学教材引入了带盐桥的原电池,该电池即为1806年丹尼尔设计的原电池.如图,下列有关分析正确的是( )| A、负极发生氧化反应:Cu-2e-=Cu2+ |
| B、电池工作时,盐桥逐渐变蓝 |
| C、向乙池中通入H2S后,电池反应停止 |
| D、若将电极Cu改为石墨,电池电流强度发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、分子式为C3H6N303 |
| B、分子中既含极性键,又含非极性键 |
| C、属于共价化合物 |
| D、生成该物质的上述反应为中和反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向氢氧化钠溶液中加入少量铝粉:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
| B、NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| C、硫化钠溶液显碱性的原因:S2-+H2O═H2S+2OH- |
| D、向FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
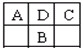 A、B、C、D为短周期元素,在周期表中如图所示:A、C两种元素的原子核外电子数之和等于B原子的核电荷数.有关说法不正确的是( )
A、B、C、D为短周期元素,在周期表中如图所示:A、C两种元素的原子核外电子数之和等于B原子的核电荷数.有关说法不正确的是( )| A、A的氧化物有多种形式 |
| B、B的最高价氧化物对应的水化物是一种强酸 |
| C、D元素形成的单质不止一种 |
| D、C的氢化物水溶液通常用玻璃试剂瓶盛放 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、-332 | B、-118 |
| C、+350 | D、+130 |
查看答案和解析>>
科目:高中化学 来源: 题型:
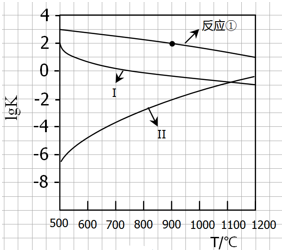 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com