
 ijʵ��С����H2O2�ֽ�Ϊ�����о�Ũ�ȡ���������Һ����ԶԷ�Ӧ���ʵ�Ӱ�죮�ڳ����°������·������ʵ�飮
ijʵ��С����H2O2�ֽ�Ϊ�����о�Ũ�ȡ���������Һ����ԶԷ�Ӧ���ʵ�Ӱ�죮�ڳ����°������·������ʵ�飮| ����ʵ�� | ���� | |
| �� | 10mL 5% H2O2��Һ | �� |
| �� | 10mL 2% H2O2��Һ | �� |
| �� | 10mL 5% H2O2��Һ | 1mL 0.1mol•L-1FeCl3��Һ |
| �� | 10mL 5%H2O2��Һ+����HCl��Һ | 1mL 0.1mol•L-1FeCl3��Һ |
| �� | 10mL 5% H2O2��Һ+����NaOH��Һ | 1mL 0.1mol•L-1FeCl3��Һ |
 ��
������ ��1��ʵ�����˫��ˮ���Ȼ����������ֽ�����ˮ���������ݴ�д��H2O2�ֽⷴӦ����ʽ�����ݻ��ϼ۱仯��������ת�Ƶķ������Ŀ��
��2��ʵ��ٺ͢ڵ�Ũ�Ȳ�ͬ��Ϊ�˱��ڱȽϣ�Ӧ����ͬ������������һ���������Ƚϣ�
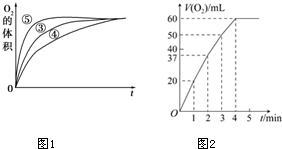
��3����ͼ��֪���ݵķ�Ӧ������ܵķ�Ӧ������С���Դ������
��4���������ŷ�Ӧ�Ľ���H2O2��Ũ�ȱ仯�жϷ�Ӧ���ʱ仯��ԭ����ͼ��֪����������ֽ���ȫ��������60mL������n=$\frac{V}{{V}_{m}}$�������������ʵ������������������������ʵ������ٸ���c=$\frac{n}{V}$������Ũ�ȣ�
��� �⣺��1��ʵ�����˫��ˮ�ֽ�ķ���ʽΪ��2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2������Ӧ��˫��ˮ����������Ҳ�ǻ�ԭ����˫��ˮ����Ԫ�ػ��ϼ�Ϊ-1�ۣ��������ʧȥ2�����ӣ�����ˮ�õ�2�����ӣ���˫���ű�������ת�Ƶķ������ĿΪ�� ��
��
�ʴ�Ϊ�� ��
��
��2��ʵ��ٺ͢ڵ�Ũ�Ȳ�ͬ�����ʵ���Ŀ��Ϊ̽��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죻Ϊ�˱��ڱȽϣ�Ӧ����ͬ������������һ���������Ƚϣ�
����Ӧ���м������ͬ�ִ�������ʢ�з�Ӧ����Թܷ���ͬһ��ˮԡ�У���
�ʴ�Ϊ��̽����Ӧ��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죻��Ӧ���м������ͬ�ִ�������ʢ�з�Ӧ����Թܷ���ͬһ��ˮԡ�У���
��3����ͼ��֪���ݵķ�Ӧ������ܵķ�Ӧ������С�����ʵ�鷽����֪�����Ի���������H2O2�ֽ�����ʣ����Ի����ܼ�СH2O2�ֽ�����ʣ�
�ʴ�Ϊ�����ԣ����ԣ�
��4����Ӧ���ʱ仯��ԭ��Ϊ�����ŷ�Ӧ�Ľ��У�H2O2��Ũ�ȼ�С����Ӧ���ʼ�����
��ͼ��֪����������ֽ���ȫ��������60mL�����������ʵ���Ϊ��$\frac{0.06L}{22.4L/mol}$=$\frac{3}{1120}$mol���ɷ�Ӧ2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2������֪������������ʵ���Ϊ��$\frac{3}{1120}$mol��2=$\frac{3}{560}$mol���ʹ�������Ũ��Ϊ��$\frac{\frac{3}{560}mol}{0.05L}$=0.11mol/L��
�ʴ�Ϊ�����ŷ�Ӧ�Ľ��У�H2O2 ��Ũ�ȼ�С����Ӧ���ʼ�����0.11mol/L��
���� ���⿼��Ӱ�컯ѧ��Ӧ���ʵ����أ���Ŀ�Ѷ��еȣ��ϺõĿ���ѧ��ʵ����ơ����ݴ�����ͼ��������ۺ�������ע����������Ӱ�컯ѧ��Ӧ���ʵ����أ�


 ����ѧ��ţ��Ӣ��ϵ�д�
����ѧ��ţ��Ӣ��ϵ�д� ��ѧ�̸̳����¿α�ϵ�д�
��ѧ�̸̳����¿α�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��pH��7����һ����c1V1��c2V2 | |
| B�� | ���κ�����¶���c��Na+��+c��H+���Tc��CH3COO-��+c��OH-�� | |
| C�� | �����������������Һǡ����ȫ��Ӧ�μӷ�̪��Һ����ɫ��� | |
| D�� | ��Ӧ�����ӷ���ʽΪ��H++OH-�TH20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ�鲽�� | ʵ��������ؽ��� |
| ��ȡ�����������Һ���Թ��У���pH��ֽ����pH�� | ����ֽ������ɫ�����ȶ���Һ��pHԼΪ14��˵����Һ���в����KOH�� |
| �ڼ�����������1mol•L-1HCl ��Һ���ټ�������0.1mol•L-1BaCl2��Һ���� | �����а�ɫ��������������Һ�к���K2SO4�� �����ް�ɫ��������������Һ��û��K2SO4�� |
| ����ȡ�����������Һ���Թ��У��ȼ�1mol•L-1��H2SO4�ữ���ٵ���2��3��0.01mol•L-1KMnO4������Һ���� | ����KMnO4��Һ�Ϻ�ɫ��ȥ����˵����Һ�к���K2SO3����KMnO4��Һ�Ϻ�ɫ���ʣ���˵����Һ����K2SO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
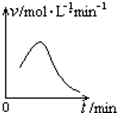 ��֪����غ����������Ʒ���������ԭ��Ӧʱ������-1�۵��Ⱥ�+6�۵���Ļ������Ӧ����v�ͷ�Ӧʱ��t�Ĺ�ϵ��ͼ��ʾ��
��֪����غ����������Ʒ���������ԭ��Ӧʱ������-1�۵��Ⱥ�+6�۵���Ļ������Ӧ����v�ͷ�Ӧʱ��t�Ĺ�ϵ��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

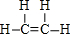 ��B�Ľṹ��ʽ��CH3CH3��
��B�Ľṹ��ʽ��CH3CH3��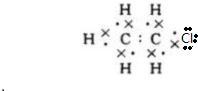 ��D�Ĺ����������ǻ���G�����ŵĽṹ��ʽ-COOH��
��D�Ĺ����������ǻ���G�����ŵĽṹ��ʽ-COOH��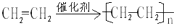 ����Ӧ���ͼӾ۷�Ӧ����
����Ӧ���ͼӾ۷�Ӧ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
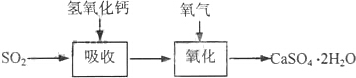
| �Լ� | Ca��OH��2 | NaOH |
| �۸�Ԫ/kg�� | 0.36 | 2.9 |
| ����SO2�ijɱ���Ԫ/mol�� | 0.027 | 0.232 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ƿ������Ļ���ɫ��dz���ڱ�����״Һ���γ� | |
| B�� | ���չ�ֱ����ܷ�����ը | |
| C�� | ����������������ȡ����Ӧ | |
| D�� | ������ֻ�� CH3Cl��CH2Cl2��CHCl3��CCl4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 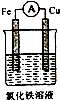 | B�� | 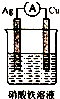 | C�� |  | D�� | 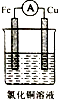 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com