
分析 (1)CO2物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,NaOH物质的量为0.1L×3mol/L=0.3mol,由于1<n(NaOH):n(CO2)=3:2<2,发生反应:2CO2+3NaOH=Na2CO3+NaHCO3+H2O,Na2CO3、NaHCO3的物质的量相等,碳酸根离子和碳酸氢根离子水解而使溶液呈碱性,碳酸根离子的水解能力大于碳酸氢根离子;
(2)反应①:2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
反应②:H2(g)+CO2(g)?H2O(g)+CO(g)△H=+41.2kJ•mol-1
根据盖斯定律,①+②可得CO2(g)+3H2(g)?CH3OH(g)+H2O(l),反应热也进行相应计算;
该反应的化学平衡常数K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$=$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})×c(CO)}$×$\frac{c({H}_{2}O)×c(CO)}{c({H}_{2})×c(C{O}_{2})}$;
(3)以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+,配平书写为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
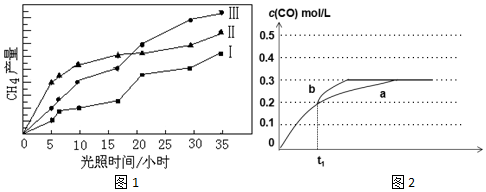
(4)相同时间内,CH4产量越高,反应催化效果越好;
(5)在t1时刻改变一个条件,曲线a变为b,缩短到达平衡的时间,反应速率加快,平衡时CO的浓度不变,改变不影响平衡移动,不可能是升高温度,反应②是反应前后气体的物质的量不变的反应,增大压强平衡不移动,但CO的浓度会增大,可能改变的条件是加入催化剂;若在t1时刻,将容器体积3L快速压缩至2L,压强增大,反应速率加快,缩短到达平衡的时间,不影响平衡移动,平衡时CO的浓度变为$\frac{0.3mol/L×3L}{2L}$=0.45mol/L,在t1时刻瞬间CO的浓度为0.3mol/L.
解答 解:(1)CO2物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,NaOH物质的量为0.1L×3mol/L=0.3mol,由于1<n(NaOH):n(CO2)=3:2<2,发生反应:2CO2+3NaOH=Na2CO3+NaHCO3+H2O,Na2CO3、NaHCO3的物质的量相等,碳酸根离子和碳酸氢根离子水解而使溶液呈碱性,即c(OH-)>c(H+),碳酸根离子水解生成碳酸氢根离子,所以c(HCO3-)>c(CO32-),由于水解程度较小,所以c(CO32-)>c(OH-),故溶液中各离子浓度大小顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(2)反应①:2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
反应②:H2(g)+CO2(g)?H2O(g)+CO(g)△H=+41.2kJ•mol-1
根据盖斯定律,①+②可得:CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H=-49.6kJ/mol,
该反应的化学平衡常数K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$=$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})×c(CO)}$×$\frac{c({H}_{2}O)×c(CO)}{c({H}_{2})×c(C{O}_{2})}$=2.5×1=2.5,
故答案为:CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H=-49.6kJ/mol;2.5;
(3)以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
故答案为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
(4)由图可知,在0-15h内,催化剂Ⅱ在相同时间内CH4产量高,对反应催化效果最好的催化剂是Ⅱ,
故答案为:Ⅱ;
(5)在t1时刻改变一个条件,曲线a变为b,缩短到达平衡的时间,反应速率加快,平衡时CO的浓度不变,改变不影响平衡移动,不可能是升高温度,反应②是反应前后气体的物质的量不变的反应,增大压强平衡不移动,但CO的浓度会增大,可能改变的条件是加入催化剂;
若在t1时刻,将容器体积3L快速压缩至2L,压强增大,反应速率加快,缩短到达平衡的时间,不影响平衡移动,平衡时CO的浓度变为$\frac{0.3mol/L×3L}{2L}$=0.45mol/L,在t1时刻瞬间CO的浓度为0.3mol/L,画出变化曲线为: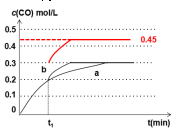 ,
,
故答案为:加入催化剂; .
.
点评 本题考查平衡常数有关计算、化学平衡计算及影响因素、离子浓度大小比较、热化学方程式书写等,题目涉及内容较多,基本属于拼合型题目,需要学生具备扎实的基础,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .某有机物a的分子式和正己烷相同,且主链上有4个碳原子,则下列关于a的观点正确的是( )
.某有机物a的分子式和正己烷相同,且主链上有4个碳原子,则下列关于a的观点正确的是( )| A. | a分子中可能有三个甲基 | |
| B. | a的分子式为C6H18 | |
| C. | a的一氯代物可能有三种 | |
| D. | 在光照条件下,a能与溴水发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S、Cl、O、F的原子半径依次减小 | |
| B. | Na、Mg、Al、Si的失电子能力依次增强 | |
| C. | C、N、O、F的气态氢化物的稳定性依次增强 | |
| D. | Si、P、S、Cl的最高价含氧酸的酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 据悉中国在建的第二艘航母中使用了素有“现代工业的骨骼”之称的碳纤维,碳纤维是一种新型的有机高分子材料 | |
| B. | 离子交换膜在工业上应用广泛,如氯碱工业使用阴离子交换膜 | |
| C. | 获得2015年诺贝尔生理学、医学奖屠呦呦女士用乙醚从黄花蒿中提取出青蒿素,该技术应用了萃取原理 | |
| D. | 酸碱指示剂变色、煤的液化、蛋白质的颜色反应、海水提取溴、焰色反应都涉及化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室利用锌片和稀硫酸制H2时,在稀硫酸中滴加MgSO4溶液可以加快反应速率 | |
| B. | 将反应2FeCl3+Cu═2FeCl2+CuCl2设计为原电池,正极反应为Cu-2e-═Cu2+ | |
| C. | 利用电解法除去酸性废水中的CN-离子,CN-在阳极被还原为N2和CO2 | |
| D. | 利用电解法精炼铜,原粗铜中的杂质有以离子形式被除去,也有以单质形式被除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水制氯气时,用铜片作阳极 | |
| B. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| C. | 在原电池中,电子流出的一极是负极,发生氧化反应 | |
| D. | 在铁制品上镀银时,铁制品与电源正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、SO42-、Fe3+、Cl- | B. | S2-、Cu2+、Na+、Cl- | ||
| C. | H+、SO42-、Cu2+、OH- | D. | Fe2+、H+、Mg2+、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com