
| A. | 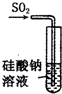 装置:可证明H2SiO3酸性与H2SO3酸性强 | |
| B. |  装置:橡胶管的作用是能使水顺利流下 | |
| C. | 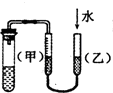 装置:用图示的方法能检查此装置的气密性 | |
| D. |  装置:可在瓶中先装入某种液体收集NO气体 |
分析 A.根据最高价氧化物的水化物的酸性比较非金属性;
B.橡皮管可使下部的压力转移到上方;
C.利用压强差检验装置的气密性;
D.NO不溶于水.
解答 解:A.根据最高价氧化物的水化物的酸性比较非金属性.亚硫酸不是最高价,故A错误;
B.橡皮管可使下部的压力转移到上方,从而利用压强平衡的原理使液体顺利流下,故B正确;
C.如果装置的气密性良好,甲、乙两侧水面高度不同,否则水面相同,所以能检验装置的气密性,故C正确;
D.NO不溶于水,可用排水法收集,故D正确;
故选A.
点评 本题考查了化学实验方案设计,涉及非金属性强弱的判断、气密性检验、气体的收集方法等知识点,明确实验原理是解本题关键,易错选项是B.


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | CaCO3═CaO+CO2↑ | B. | NaHCO3+NaOH═Na2CO3+H2O | ||
| C. | Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO | D. | 3K2MnO4+2H2O═2KMnO4+MnO2↓+4KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知氢气的燃烧热为285.8kJ/mol,相应的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(g),△H=-285.8 kJ/mol | |
| B. | 中和相同体积、相同物质的量浓度的①硫酸,②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3 | |
| C. | 稀氨水中部分粒子的浓度大小关系:c(NH3•H2O)>c(OH-)>c(NH${\;}_{4}^{+}$)>c(H+) | |
| D. | 1mol/LNaX和1mol/LNaY两种盐溶液中c(X-)═c(Y-)+c(HY),则HX为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
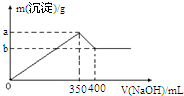
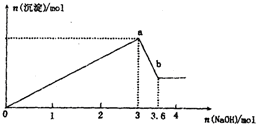 现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.
现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属及其化合物在化学中扮演着重要的角色,同学们应该熟练掌握它们的性质.
金属及其化合物在化学中扮演着重要的角色,同学们应该熟练掌握它们的性质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验装置图 | 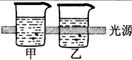 |  | 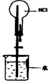 | 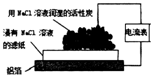 |
| 实验现象 | 乙装置中有亮光通路,甲装置无明显现象 | 关闭止水夹,捂住圆底烧瓶,导管中水柱上升后静止不动 | 打开止水夹,挤压胶头滴管中的水,有喷泉产生 | 电流表指针发生偏转 |
| 实验结论 | 甲装置中分散系不是胶体,乙装置中分散系为胶体 | 该装置气密性良好 | HCl易溶于水 | 电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W>Y>Z>X | B. | Y>X>W>Z | C. | Y>X>Z>W | D. | Z>Y>X>W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com