
 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.分析 (1)镓是31号元素,根据原子核外电子排布规律可以写出电子排布式;
(2)砷、硒、溴三种元素都是第4周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但砷元素原子4p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能Br>As>Se,据此答题;
(3)气态SeO3分子中中心原子的价层电子对数可以判断分子构型;
(4)硅烷(SinH2n+2)都是分子晶体,分子晶体的沸点高低取决于分子间作用力,而分子间作用力与相对分子质量的大小有关,据此答题;
(5)根据价层电子对互斥理论确定其杂化方式;
(6)根据氧化还原反应中元素和电荷守恒,可写出离子方程式;
(7)利用均摊法计算两种金属原子个数之比,根据ρ=$\frac{m}{v}$计算.
解答 解:(1)镓是31号元素,根据原子核外电子排布规律可以写出电子排布式为:1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1),
故答案为:1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1);
(2)砷、硒、溴三种元素都是第4周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但砷元素原子4p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能Br>As>Se,故答案为:Br>As>Se;
(3)气态SeO3分子中中心原子的价层电子对数为$\frac{6+0}{2}$=3,无孤电子对,所以分子构型为平面三角形,故答案为:平面三角形;
(4)硅烷(SinH2n+2)都是分子晶体,分子晶体的沸点高低取决于分子间作用力,而分子间作用力与相对分子质量的大小有关,硅烷的相对分子质量越大,分子间范德华力越强,故答案为:硅烷的相对分子质量越大,分子间范德华力越强;
(5)[B(OH)4]-中B的价层电子对=4+$\frac{1}{2}$(3+1-4×1)=4,所以采取sp3杂化,故答案为:sp3;
(6)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,说明两者能互相促进,是两种物质共同作用的结果,其中过氧化氢为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行,方程式可表示为:Cu+H2O2+4NH3•H2O=Cu(NH3)42++2OH-+4H2O,
故答案为:Cu+H2O2+4NH3•H2O=Cu(NH3)42++2OH-+4H2O;
(7)在晶胞中,Au原子位于顶点,Cu原子位于面心,该晶胞中Au原子个数=8×$\frac{1}{8}$=1,Cu原子个数=6×$\frac{1}{2}$=3,所以该合金中Au原子与Cu原子个数之比=1:3,
晶胞体积V=(a×10-10cm)3,每个晶胞中铜原子个数是3、Au原子个数是1,则ρ=$\frac{\frac{197+64×3}{{N}_{A}}}{(a×1{0}^{-10})^{3}}$g•cm-3,
故答案为:1:3;$\frac{\frac{197+64×3}{{N}_{A}}}{({a×1{0}^{-10})}^{3}}$.
点评 本题主要考查了核外电子排布、第一电离能、分子空间构型、杂化方式、晶胞密度的计算,难度中等,解题时要注意对基本知识的灵活运用.


科目:高中化学 来源: 题型:解答题
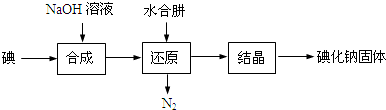
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
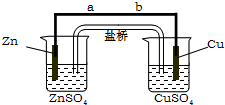 某学生利用下面实验装置探究盐桥式原电池的工作原理.按照实验步骤依次回答下列问题:
某学生利用下面实验装置探究盐桥式原电池的工作原理.按照实验步骤依次回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
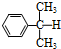 )氧化法是工业生产苯酚和丙酮最主要的方法.其反应和流程如下:
)氧化法是工业生产苯酚和丙酮最主要的方法.其反应和流程如下: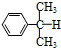 +O→
+O→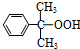 (异丙苯过氧氢)
(异丙苯过氧氢)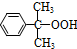 $→_{50-60℃}^{H+}$
$→_{50-60℃}^{H+}$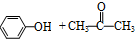 (丙嗣)
(丙嗣)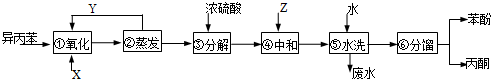
| 物质 | 丙酮 | 苯酚 | 异丙苯 |
| 密度(g/mL) | 0.7898 | 1.0722 | 0.8640 |
| 沸点/°C | 56.5 | 182 | 153 |
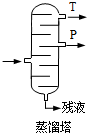 ,产品T是丙酮,
,产品T是丙酮, ;第1加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是溴易挥发.
;第1加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是溴易挥发.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
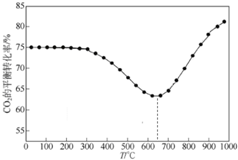 CO2是自然界中碳循环的主要载体,维持大气中CO2的平衡对生态环境有重要意义.
CO2是自然界中碳循环的主要载体,维持大气中CO2的平衡对生态环境有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2+2H2O═2Na++2OH-+H2↑ | B. | 2O22-+4H+═4OH-+O2↑ | ||
| C. | Na2O2+2H2O═2Na++2OH-+O2↑ | D. | 2Na2O2+2H2O═4Na++4OH-+O2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com