
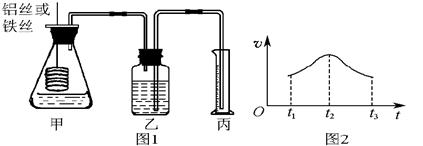
科目:高中化学 来源:不详 题型:实验题
| 实验 组号 | 温度] | Na2S2O3溶液 | H2SO4 | 加入H2O的体积 | 出现沉淀所需时间 | ||
| 体积 | 浓度 | 体积 | 浓度 | ||||
| Ⅰ | 0℃ | 5mL | 0.1mol·L-1 | 10mL | 0.1mol·L-1 | 5mL | 8s |
| Ⅱ | 0℃ | 5mL | 0.1mol·L-1 | 5mL | 0.1mol·L-1 | 10mL | 12s |
| Ⅲ | 30℃ | 5mL | 0.1mol·L-1 | 5mL | 0.1mol·L-1 | 10mL | 4s |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 重性质。
重性质。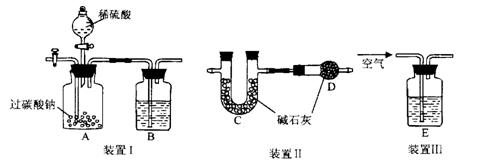
 证产生的两种气体,B中盛有足量的Ba(OH)2溶液,若观察到的现象是 ,则证明有 气体生成;简述验证另一种气体的方法 ;
证产生的两种气体,B中盛有足量的Ba(OH)2溶液,若观察到的现象是 ,则证明有 气体生成;简述验证另一种气体的方法 ; 装置III中通空气的目的是 。
装置III中通空气的目的是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 2Fe+ Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褪褐色硬块的组成。
2Fe+ Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褪褐色硬块的组成。| 实验操作 | 预期现象和结论 |
 步骤1:取少量粉末于烧杯中,加入足量3mol/LNaOH溶液,充分搅拌,过滤,洗涤。 步骤1:取少量粉末于烧杯中,加入足量3mol/LNaOH溶液,充分搅拌,过滤,洗涤。 | |
| 步骤2:将步骤1的滤渣转移到烧杯B中,加入足量 ,充分搅拌,过滤,洗涤。 | 有红色固体生成,说明粉末中含有 。 |
| 步骤3:将步骤2的滤渣转移到烧杯C中, 。 | , 说明粉末中含有Fe2O3。(1分) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
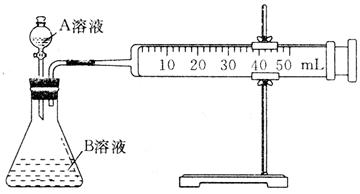
| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.1 mol·L-1 H2C2O4溶液 | 4mL 0.01 mol·L-1 KMnO4溶液 |
| ② | 2mL 0.2 mol·L-1 H2C2O4溶液 | 4mL 0.01 mol·L-1 KMnO4溶液 |
| ③ | 2mL 0.2 mol·L-1L H2C2O4溶液 | 4mL 0.01 mol·L-1 KMnO4溶液、少量催化剂 |
 率的大小。取两支试管各加入2
率的大小。取两支试管各加入2 0.1
0.1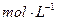 H2C2O4溶液,另取两支试管各加入4
H2C2O4溶液,另取两支试管各加入4 0.1
0.1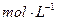 KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。
KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.容量瓶未干燥即用来配制溶液 | B.往容量瓶转移溶液时有少量液体溅出 |
| C.未洗涤溶解固体的烧杯 | D.定容时,仰视刻度线 |

| | 密度/g·mL-1 | 沸点/℃ | 溶解性 |
| 溴乙烷 | 1.461 | 38 | 难溶于水 |
| 乙醇 | 0.789 | 78 | 易溶于水 |
查看答案和解析>>
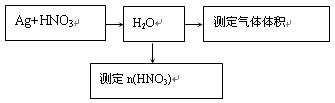
科目:高中化学 来源:不详 题型:实验题
| 方法 | 需测定的数据 |
| ① | 测定产生的H2的体积 |
| ② | |
| 实验操作 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| …… | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
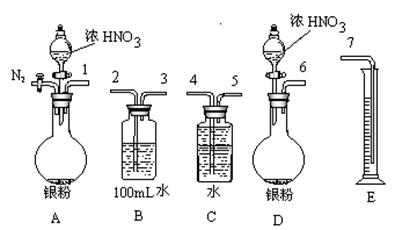
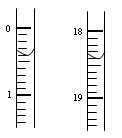
| | 滴定前读读数/mL | 滴定后读数/mL |
| 第一次 | | |
| 第二次 | 0.10 | 18.00 |
| 第三次 | 0.20 | 18.30 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com