
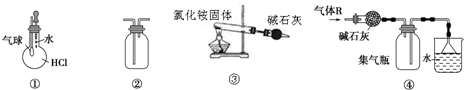
| A. | 装置①可验证HCl气体在水中的溶解性 | |
| B. | 装置②可用排空气法收集H2、NH3、Cl2、HCl、CO2等气体 | |
| C. | 装置③实验室用氯化铵制少量氨气 | |
| D. | 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢 |
分析 A.HCl极易溶于水,挤压胶头滴管,瓶内气体减少;
B.导管长进短出收集密度比空气密度大的气体,导管短进长出收集密度比空气密度小的气体;
C.氯化铵分解后,在试管口又化合生成氯化铵;
D.HCl与碱石灰反应,且HCl的密度比空气密度大.
解答 解:A.HCl极易溶于水,挤压胶头滴管,瓶内气体减少,则气球变大可说明HCl气体在水中的溶解性,故A正确;
B.导管长进短出收集Cl2、HCl、CO2等气体,导管短进长出收集H2、NH3气体,故B正确;
C.氯化铵分解后,在试管口又化合生成氯化铵,不能制备氨气,应利用铵盐与碱加热制备,故C错误;
D.HCl与碱石灰反应,且HCl的密度比空气密度大,则不能利用碱石灰干燥,且收集方法不合理,故D错误;
故选AB.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、常见气体的制备实验、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验装置的作用及实验评价性分析,题目难度中等.


科目:高中化学 来源: 题型:解答题
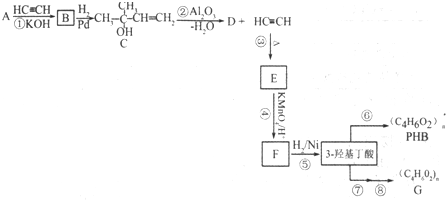
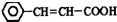 ,可由化合物甲生成.其转化关系及相应反应如下:
,可由化合物甲生成.其转化关系及相应反应如下: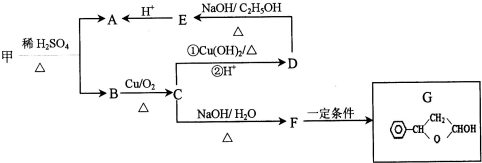

 .
. (写结构简式);立体异构中有一种形式为顺反异构,当相同原子或基团在双键平面同一侧时为顺式结构,在异侧时为反式结构,则A的顺式结构简式为
(写结构简式);立体异构中有一种形式为顺反异构,当相同原子或基团在双键平面同一侧时为顺式结构,在异侧时为反式结构,则A的顺式结构简式为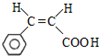 .
.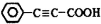 是重要的有机合成工业中间体之一,广泛用于医药、香料、塑料和感光树脂等化工产品,参照上述反应路线,设计一条以A为原料合成的
是重要的有机合成工业中间体之一,广泛用于医药、香料、塑料和感光树脂等化工产品,参照上述反应路线,设计一条以A为原料合成的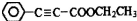 路线(其他试剂任选)
路线(其他试剂任选)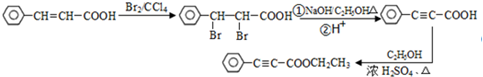 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碘单质能升华是由于碘单质分子间的键能较小 | |
| B. | 键能越大,则含该键的分子受热越易分解为原子 | |
| C. | 燃料燃烧过程中,反应物的总能量总是高于生成物的总能量 | |
| D. | H-Cl键的键能为431kJ•mol-1,H-I键的键能为299kJ•mol-1,这说明HCl分子比HI分子稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

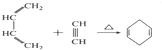
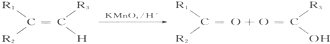
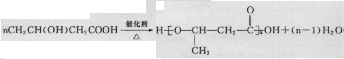
 B.
B.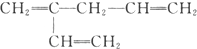 C.
C.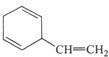 D.
D.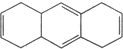
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
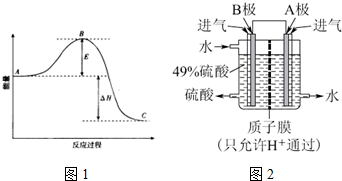
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10O | B. | C4H4O2 | C. | C3H6O2 | D. | C4H8O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 431KJ | B. | 649KJ | C. | 869KJ | D. | 945.6KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.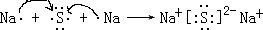
 ,该化合物是由极性(填“极性”“非极性”)键形成的.
,该化合物是由极性(填“极性”“非极性”)键形成的.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com