

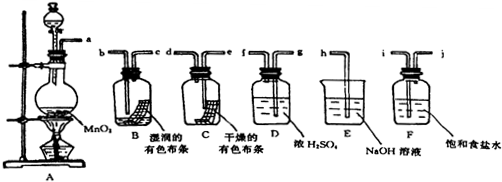
分析 亚硫酸盐与稀硫酸反应生成气体SO2,为防止液体加热时暴沸,一般可加入碎瓷片,因定量实验,需考查减小实验操作误差,通入N2可将生成的SO2全部赶出,保证被吸收液全部吸收,二氧化硫被过氧化氢吸收得到硫酸溶液,以后氢氧化钠溶液标定,二氧化硫被碱溶液吸收,用盐酸调节溶液呈弱酸性得到溶液B,用碘单质滴定后进行数据处理,
(1)亚硫酸盐与稀硫酸反应生成气体SO2,反应时加入碎瓷片防止暴沸,要保证SO2全部赶出.
(2)SO2具有还原性,可被氧化剂H2O2所氧化;
(3)用标准液润洗滴定管时,务必注意最后将润洗液从滴定管下端放出,而不是从上口倒出;
(4)根据SO2用碱液吸收后需再用盐酸调节溶液至弱酸性分析;
(5)利用关系式法计算.
解答 解:(1)亚硫酸盐与稀硫酸反应生成气体SO2,为防止液体加热时暴沸,一般可加入碎瓷片,故答案为:SO2、N2;碎瓷片;
(2)SO2具有还原性,可被氧化剂H2O2所氧化,反应的离子方程式为SO2+H2O2=SO42-+2H+,
故答案为:SO2+H2O2=SO42-+2H+;
(3)用标准液润洗滴定管时,务必注意最后将润洗液从滴定管下端放出,而不是从上口倒出,具体操作是在碱式滴定管中加入1-2mL标准NaOH溶液,将滴定管横过来并转动,让NaOH溶液浸过滴定管内壁,从下面放掉浸洗液,重复操作2-3次,
故答案为:在碱式滴定管中加入1-2mL标准NaOH溶液,将滴定管横过来并转动,让NaOH溶液浸过滴定管内壁,从下面放掉浸洗液,重复操作2-3次;
(4)用盐酸代替硫酸,生成的SO2气体中混有少量HCl,因SO2用碱液吸收后需再用盐酸调节溶液至弱酸性,因此混合气体中含有HCl,对实验结果无影响,
故答案为:无影响;
(5)反应的离子方程式为H2O+SO32-+I2=SO42-+2H++2I-,SO2~SO32-~I2,
64g 1mol
m 0.01000mol•L-1×V×10-3L=10-5mol
m=64×V×10-5g,则1kg样品中含SO2的质量为$\frac{64×V×1{0}^{-5}g×1000}{w}$=$\frac{0.64V}{w}$,
故答案为:$\frac{0.64V}{w}$.
点评 本题属工业流程题以食品中的亚硫酸盐含量的测定为问题情境,通过简明的实验流程图,将实验基本操作、仪器的使用、化学计算、化学方程式的书写等内容综合在一起,考查考生对化学实验方案的分析和问题解决的能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
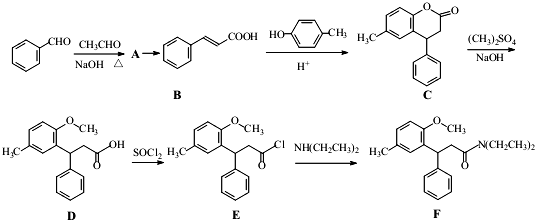
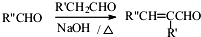
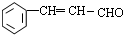 .
.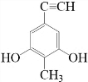 (或
(或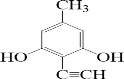 、
、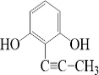 、
、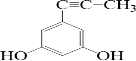 );.(任写一种)
);.(任写一种)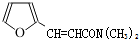 )是一种高效麻醉剂,写出以
)是一种高效麻醉剂,写出以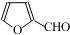 、CH3CHO、NH(CH3)2为原料制备呋喃丙胺的合成路线流程图(无机试剂自选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CHCH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
、CH3CHO、NH(CH3)2为原料制备呋喃丙胺的合成路线流程图(无机试剂自选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CHCH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
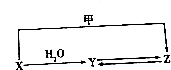 有机物X、Y、Z的转化关系如图所示(化学反应条件已省略),又己知X的储量是衡量一个国家石油化工发展水平的标志,甲是空气的主要成分之一,Y是一种常用的液体燃料.
有机物X、Y、Z的转化关系如图所示(化学反应条件已省略),又己知X的储量是衡量一个国家石油化工发展水平的标志,甲是空气的主要成分之一,Y是一种常用的液体燃料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH- | |
| B. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+ | |
| C. | 用惰性电极分别电解熔融氯化钠和饱和食盐水时,阳极的电极反应式均为:2Cl--2e-=Cl2↑ | |
| D. | 钢铁发生吸氧腐蚀时的正极反应式:Fe-2e-=Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | X | Y | Z | W | 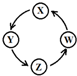 |
| ① | Cu | CuSO4 | Cu(OH)2 | CuO | |
| ② | Na | NaOH | Na2CO3 | NaCl | |
| ③ | Al | AlCl3 | Al(OH)3 | Al2O3 | |
| ④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
| A. | ②③ | B. | ①③④ | C. | ①④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaAlO2溶液中通入足量的CO2:2AlO${\;}_{2}^{-}$+CO2+3H2O=2Al(OH)3↓+CO${\;}_{3}^{2-}$ | |
| B. | (NH4)2Fe(SO4)2溶液中加入少量氢氧化钡溶液:NH${\;}_{4}^{+}$+SO${\;}_{4}^{2-}$+Ba2++OH-=BaSO4↓+NH3•H2O | |
| C. | NH4Cl浓溶液中滴加浓NaOH溶液并加热:NH${\;}_{4}^{+}$+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO${\;}_{3}^{-}$=3Fe3++NO↑+2H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com