


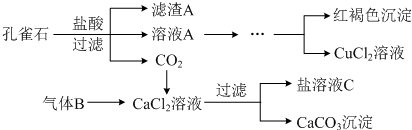
分析 大理石(含少量的Fe2O3杂质),加入硝酸溶解后的溶液中加入氨水沉淀铁离子生成氢氧化铁,过滤得到硝酸钙溶液,加入碳酸铵发生沉淀反应生成碳酸钙,分离得到碳酸钙固体和滤液A,滤液A”中除H+离子外,还含有的阳离子是铵根离子,
(1)①依据硫酸和碳酸钙反应生成的硫酸钙是微溶于水的物质,附着在大理石表面阻止反应进行;
②沉淀过滤后洗涤,干燥;
③依据流程分析,大理石与硝酸反应后生成硝酸钙,硝酸铁,加入一水合氨反应生成氢氧化铁沉淀,滤液中加入碳酸铵反应生成碳酸钙沉淀,过滤得到碳酸钙,滤液中含有氢离子,铵根离子;
(2)在加热到t1时xCaSO4•yH2O开始分解,t1~t2时间段和t3~t4时间段个固体的质量变化比较少,而t5~t6时间段固体质量变化较大,原因是t1~t2时间段生石膏脱去部分水,t3~t4时间段完全脱水,在t4时完全生成CaSO4,在t5~t6时间段温度较高,CaSO4开始分解,质量变化较大.
解答 解:(1)①硫酸和碳酸钙反应生成的硫酸钙是微溶于水的物质,附着在大理石表面阻止反应进行,所以选择硝酸反应;
故答案为:硫酸钙微溶于水;
②上述流程中,“分离”得产品为碳酸钙沉淀和硝酸铵溶液,所包含的实验操作依次为过滤,洗涤,干燥;
故答案为:过滤,干燥;
③大理石与硝酸反应后生成硝酸钙,硝酸铁,加入一水合氨反应生成氢氧化铁沉淀,滤液中加入碳酸铵反应生成碳酸钙沉淀,过滤得到碳酸钙,滤液中含有阳离子为氢离子,铵根离子,
故答案为:NH4+;
(2)①依据图象分析,固体质量在0-t1时间段无变化,说明固体未反应,加热到t1时,固体质量开始减小,所以该晶体开始发生化学变化的时间是t1;
故答案为:t1;
②在加热到t1时xCaSO4•yH2O开始分解,t1~t2时间段和t3~t4时间段个固体的质量变化比较少,而t5~t6时间段固体质量变化较大,原因是t1~t2时间段生石膏脱去部分水,t3~t4时间段完全脱水,t4~t5时间段固体的化学式为CaSO4;
故答案为:CaSO4;
③t3~t4时间段完全脱水,则m(H2O)=6.52g-5.44g=1.08g,m(CaSO4)=5.44g,n(H2O)=$\frac{1.08g}{18g/mol}$=0.06mol,n(CaSO4)=$\frac{5.44g}{136g/mol}$=0.04mol,所以n(CaSO4):n(H2O)=x:y=0.04:0.06=2:3,化学式为:2CaSO4•3H2O,tl~t2时间段固体质量变化,减少水的质量=6.52g-5.80g=0.72g,n(H2O)=$\frac{0.72g}{18g/mol}$=0.04mol;固体质量为5.80g,6.52g硫酸钙固体物质的量=$\frac{6.52g}{326g/mol}$=0.02mol,则1mol2CaSO4•3H2O失水2mol,反应的化学方程式为:2CaSO4•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4•H2O+2H2O,
故答案为:2CaSO4•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4•H2O+2H2O.
点评 本题考查了碳酸钙制备流程分析判断,生石膏加热的变化图象,题目难度较大,注意根据图象的质量变化判断可能发生的反应.


科目:高中化学 来源:2017届广西桂林十八中高三上10月月考化学试卷(解析版) 题型:选择题
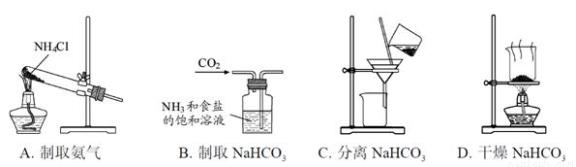
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是( )
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | |
| SO3 | 0mol | 4mol | 2mol | 0mol |
| SO2 | 4mol | 1.5mol | 0mol | 4mol |
| O2 | 2mol | 0mol | 0mol | 4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当SO3的生成速率与SO2的消耗速率相等时反应达到平衡 | |
| B. | 降低温度,正反应速率减小,而逆反应速率增大 | |
| C. | 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980 g | |
| D. | 达到平衡时,SO2的转化率是90% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| B. | KI溶液与H2SO4酸化的H2O2溶液混合:2 I-+H2O2+2 H+=2 H2O+I2 | |
| C. | 向NH4HCO3溶液中滴加过量Ba(OH)2溶液:HCO3-+OH-+Ba2+=H2O+BaCO3↓ | |
| D. | 高锰酸钾酸性溶液吸收二氧化硫:SO2+MnO4-+4H+=SO42-+Mn2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ⑥ | C. | ①②③④⑤⑦⑧ | D. | ②④⑥⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com