
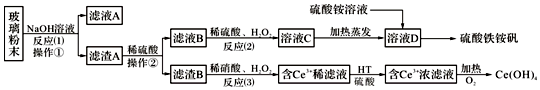
���� �ϲ�����ĩ������������Һ����ˣ��õ�����A�ijɷ���Fe2O3��CeO2��FeO������A��Fe2O3��CeO2��FeO����ϡ�������˵���ҺB������������Һ��������������������������������ҺC��Ϊ�������������������������ⲻ���������ʣ����������õ���ҺDΪ������������Һ������Һ�м����������Һ�õ�������立�������B�ijɷ���CeO2��CeO2��H2O2��ϡH2SO4��Ӧ����Ce3+��O2������HT������ȡ����Ce3+��ˮ��Һ����ȡ������Ce3+�Ӽ����������������ԭ��Ӧ����Ce��OH��4���Դ˽����⣮
��� �⣺�ϲ�����ĩ������������Һ����ˣ��õ�����A�ijɷ���Fe2O3��CeO2��FeO������A��Fe2O3��CeO2��FeO����ϡ�������˵���ҺB������������Һ��������������������������������ҺC��Ϊ�������������������������ⲻ���������ʣ����������õ���ҺDΪ������������Һ������Һ�м����������Һ�õ�������立�������B�ijɷ���CeO2��CeO2��H2O2��ϡH2SO4��Ӧ����Ce3+��O2������HT������ȡ����Ce3+��ˮ��Һ����ȡ������Ce3+�Ӽ����������������ԭ��Ӧ����Ce��OH��4��
��1��ͨ�������ٵõ���������Һ���������Ϊ���ˣ�������Ҫ�IJ����������ձ�����������©����
�ʴ�Ϊ�����ˣ�©������������
��2����Ӧ����H2O2������������ʹ��������Ϊ�����ӣ�
�ʴ�Ϊ������ʹFe2+ת��ΪFe3+��
��3����Ӧ����������Һ��CeO2���������ԭ����Ce3+���ӣ��������ⱻ����������������Ӧ�����ӷ���ʽ2GeO2+6H++H2O2=2Ge3++4H2O+O2����
�ʴ�Ϊ��2GeO2+6H++H2O2=2Ge3++4H2O+O2����
��4���л���HT�ܽ�Ce3+��ˮ��Һ����ȡ�������ù��̿ɱ�ʾΪ��2Ce3+��ˮ�㣩+6HT���л��㣩�T2CeT3���л��㣩+6H+��ˮ�㣩��������������������Ũ�ȣ�ƽ������������γ�Ge3+ˮ��Һ�����ƶ�����ýϴ��ĺ�Ce3+��ˮ��Һ��
�ʴ�Ϊ�����Һ�м���H2SO4ʹc��H+������ƽ�����γ�Ge3+ˮ��Һ�����ƶ���
��5��������立�[Fe2��SO4��3•��NH4��2SO4•24H2O]�㷺����ˮ�ľ����������侻ˮԭ�����ܽ����Һ�е�������ˮ�����������������壬������������������ʵ����ã����Ծ�ˮ����Ӧ�����ӷ���ʽΪ��Fe3++3H2O=Fe��OH��3�����壩+3H+��
�ʴ�Ϊ��Fe3++3H2O=Fe��OH��3�����壩+3H+��
��6����ͬ���ʵ���Ũ�ȵ�����������Һ�У�
a��xFe2��SO4��3•y��NH4��2SO4•zH2O ��Һ��������ˮ������������笠�����ˮ�⣬笠�����Ũ������
b����NH4��2SO4 ��Һ����������Ӷ�笠�����ˮ����Ӱ�죻
c����NH4��2CO3����Һ��̼�������ˮ���Լ��Դٽ�笠�����ˮ�⣬笠�����Ũ�ȼ�С��
d��NH3•H2O�����������笠�����Ũ����С��
�ʴ�Ϊ��a��b��c��d��
��7����ȡ14.00g��Ʒ����������ˮ���ó�100mL��Һ���ֳ����ȷݣ�������һ���м�������NaOH��Һ������ϴ�ӵõ�������������������صõ�1.60g����Ϊ��������n��Fe2O3��=$\frac{1.6g}{160g/mol}$=0.01mol���������������������ʵ���Ϊ��n��Fe��OH��3��=0.02mol��
����һ����Һ�м���0.05mol Ba��NO3��2��Һ��ǡ����ȫ��Ӧ����n��SO42-��=0.05mol��
����14.00g��Ʒ�к���Fe2��SO4��30.02mol��n��SO42-��Ϊ0.1mol����NH4��2SO4Ϊ0.1mol-0.02mol��3=0.04mol��
��m��H2O��=14.00g-0.02mol��400g/mol-0.04mol��132g/mol=0.72g��n��H2O��=$\frac{0.72g}{18g/mol}$=0.04mol��
��n��Fe2��SO4��3����n����NH4��2SO4����n��H2O��=0.02��0.04��0.04=1��2��2��
���Ի�ѧʽΪFe2��SO4��3•2��NH4��2SO4•2H2O��
�ʴ�Ϊ��Fe2��SO4��3•2��NH4��2SO4•2H2O��
���� �����Թ�������Ϊ�����������˻�ѧʵ�����������Ԫ�ؼ�������֪ʶ��Ӧ�����֪ʶ���ᴿ�Ʊ���Ϊ�߿��������ͣ�������ѧ���ķ���������ʵ�������ͼ��������Ŀ��飬ע�����ʵ���ԭ���Ͳ�����������Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ��ȡ����ʱ����������Ҫ������������ͨ����Һ©���ϿڵIJ��������е� | |
| B�� | ���ȵ�������ʹ��ʧȥ�ᾧˮ����ͼ3װ�� | |
| C�� | ����CCl4��I2�Ļ��Һ����ͼ1��ͼ2���� | |
| D�� | ����ˮ�õ���ˮ����ͼ4װ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������Һ��ͭ��Ӧ Cu+Ag+�TCu2++Ag | |
| B�� | ���۸�ϡ���ᷴӦ 2Fe+6H+�T2Fe3++3H2�� | |
| C�� | ���������������Ӧ��H++SO42-+Ba2++OH-�TH2O+BaSO4 | |
| D�� | ��С�մ�����θ����ࣺHCO3-+H+�TCO2��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڷ�ӦKClO3+6HCl=KCl+3Cl2��+3H2O�У����õ���״����67.2 L Cl2ʱ����Ӧ��ת�Ƶĵ�����Ϊ6 NA | |
| B�� | 6.0 g SiO2�����к��еĹ�������ĿΪ0.2 NA | |
| C�� | ��״���£�22.4 L NO��11.2 L O2��Ϻ�����ķ�������ΪNA | |
| D�� | S2��S8�Ļ���ﹲ6.4 g������������ԭ����һ��Ϊ0.2 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��̬���� | B�� | ������Ԫ�ص����� | ||
| C�� | Һ̬���� | D�� | û����ɫ����Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com