
| A. | 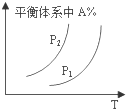 图中,若P1>P2,则该反应在较低温度下有利于自发进行 | |
| B. |  图中,若T2>T1,则△H<0且a+b=c+d | |
| C. | 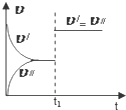 图中(v′表示正反应速率,v″表示逆反应速率),t1时刻改变的条件一定是使用了催化剂 | |
| D. | 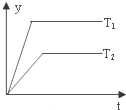 图中,若△H<0,则纵坐标不可能表示的是反应物的转化率 |
分析 A、由反应1图可知,增大压强,A的含量减少,平衡正向移动,说明正反应是熵减的反应,升温A的含量增加,平衡逆向移动,说明正反应是放热反应;
B、温度越高,A的转化率越低,说明该反应为放热反应,压强增大,A的转化率不变,则压强对平衡无影响;
C、根据图象条件改变,使反应速率同时增大并且平衡不移动,说明可能是加催化剂或者增压;
D、由图可知,T1的起始斜率大于T2,说明T1>T2,升高温度,若△H<0,平衡逆向移动,说明反应物的转化率减小.
解答 解:A、由反应1图可知,增大压强,A的含量减少,平衡正向移动,说明正反应是熵减的反应,升温A的含量增加,平衡逆向移动,说明正反应是放热反应,根据△G=△H-T△S可知,该反应在低温度时更容易自发进行,故A正确;
B、温度越高,A的转化率越低,说明该反应为放热反应,△H<0,压强增大,A的转化率不变,则压强对平衡无影响,所以a+b=c+d,故B正确;
C、根据图象条件改变,使反应速率同时增大并且平衡不移动,说明可能是加催化剂或者在反应前后气体系数和相等时增压,故C错误;
D、由图可知,T1的起始斜率大于T2,说明T1>T2,升高温度,若△H<0,平衡逆向移动,说明反应物的转化率减小,而图象是温度越高越大,所以不可能表示的是反应物的转化率,故D正确;
故选C.
点评 本题主要考查了根据图象判断反应的特征,中等难度,解题时要注意观察图以及基础本原理的应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | ||
| 0.6 mol/L H2C2O4溶液 | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 1.0 | 2.0 | 6.4 |

| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | ||
| 0.6 mol/L H2C2O4溶液 | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 4 | 3.0 | 3.0 | 2.0 | t | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食醋呈酸性的原因是:CH3COOH+H2O=CH3COO-+H3O+ | |
| B. | 纯碱溶液呈碱性的原因是:CO32-+2H2O?H2CO3+2OH- | |
| C. | 用铁作阳极,电解饱和食盐水的离子方程式:Fe+2H2O $\frac{\underline{\;电解\;}}{\;}$ Fe(OH)2+H2↑ | |
| D. | 表示氢气燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H=-571.6KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
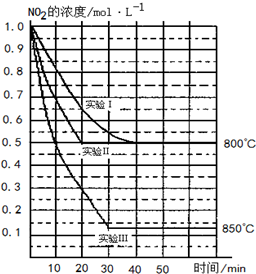 某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.请回答下列问题:
某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 键的极性:H2O>H2S | B. | 导电性:HF溶液<HCl溶液 | ||
| C. | 燃烧热:△H(C)(s,石墨)>△H(CO)(g) | D. | 耐腐蚀性:铝<生铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有很高的熔点和沸点 | B. | 易汽化,可用作制冷材料 | ||
| C. | 含有极性共价键 | D. | 硬度大,可用作耐磨材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠久置于空气中,可以和空气中的有关物质反应,最终生成NaHCO3 | |
| B. | 氮气的化学性质通常非常稳定,但在放电条件下可以与O2反应生成NO2 | |
| C. | 海水制食盐、石油分馏、焰色反应都属于物理变化 | |
| D. | 钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com