
 CH3OH + H2O
CH3OH + H2O

科目:高中化学 来源:不详 题型:单选题
| A.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷高 |
| B.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷低 |
| C.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷高 |
| D.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.该反应是放热反应 |
| B.该反应的反应热△H=-234 kJ/mol |
| C.加入催化剂,使该反应的活化能降低,反应速率加快,同时使该反应的反应热数值减小 |
D.由图可推出:NO(g)+CO2(g) NO2(g)+CO(g)△H=+234 kJ/mol NO2(g)+CO(g)△H=+234 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定 |
| B.锥形瓶用蒸馏水洗涤后未用待测液润洗 |
| C.读取标准液读数时,滴定前平视,滴定到终点后俯视 |
| D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失 |
| A.托盘天平 | B.量筒 |
| C.碱式滴定管 | D.酸式滴定管 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.某反应在低温条件下能自发进行,那么该反应在高温条件下也一定能自发进行 |
| B.某反应在高温条件下不能自发进行,那么该反应在低温条件下也一定不能自发进行 |
| C.反应方向是由焓变和熵变共同决定的,与反应温度无关 |
| D.温度有可能对反应的方向起决定性作用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Q1=Q2=Q3 | B.Q2>Q1>Q3 | C.Q2>Q3>Q1 | D.Q2=Q3>Q1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
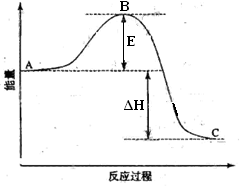
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2; 则:△H1>△H2 |
| B.C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol,则:由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定 |
| C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol,则:含20gNaOH的溶液与稀盐酸完全反应,放出的热量为28.7kJ |
| D.CaCO3(s)=CaO(s)+CO2(g)△H>0,△S>0,则:该反应任何温度下都能自发进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com