【答案】
分析:(1)N
2H
4中N原子之间形成1对共用电子对,N原子H原子质量形成1对共用电子对;
H
2O
2中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对;
(2)根据产物分析,产物为氮气和水,无污染;
(3)0.4mol液态肼和足量双氧水反应生成氮气和水蒸气时放出256.65KJ的热量,1mol液态肼放出的热量为256.65kJ×
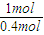
=641.625kJ,结合热化学方程式书写原则进行书写;
(4)根据n=
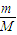
计算16g液态肼的物质的量,根据(3)中的热化学方程式,构造出生成液态水时的热化学方程式,据此计算;
(5)根据盖斯定律,利用已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应物也乘以相应的系数,进行相应的加减.
解答:解:(1)N
2H
4中N原子之间形成1对共用电子对,N原子H原子质量形成1对共用电子对,结构式为

;
H
2O
2中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对,结构式为H-O-O-H,
故答案为:
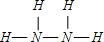
;H-O-O-H;
(2)肼(N
2H
4)和H
2O
2反应,产物为氮气和水,无污染,故答案为:产物为氮气和水,无污染;
(3)0.4mol液态肼和足量双氧水反应生成氮气和水蒸气时放出256.65KJ的热量,1mol液态肼放出的热量为256.65kJ×
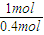
=641.625kJ,
该反应热化学方程式为:N
2H
4(l)+2H
2O
2(l)═N
2(g)+4H
2O(g)△H=-641.625kJ/mol,
故答案为:N
2H
4(l)+2H
2O
2(l)═N
2(g)+4H
2O(g)△H=-641.625kJ/mol;
(4)已知:①N
2H
4(l)+2H
2O
2(l)═N
2(g)+4H
2O(g)△H=-641.625kJ/mol,
②H
2O(l)═H
2O(g)△H=+44KJ/mol,
根据盖斯定律,①-②×4得N
2H
4(l)+2H
2O
2(l)═N
2(g)+4H
2O(g)△H=-817.625kJ/mol,
16g液态肼的物质的量为
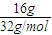
=0.5mol,完全反应生成液态水时放出的热量为0.5mol×817.625kJ/mol=408.8k,J
故答案为:408.8kJ;
(5)已知:Ⅰ、N
2 (g)+2O
2(g)=2NO
2 (g)△H=+67.7kJ/mol
Ⅱ、N
2H
4(g)+O
2 (g)=N
2(g)+2H
2O (g)△H=-543kJ/mol
根据盖斯定律,Ⅱ×2-Ⅰ得2N
2H
4(g)+2NO
2(g)═3N
2(g)+4H
2O(g)△H=-1153.7KJ/mol,
已知:Ⅰ、N
2H
4(g)+O
2 (g)=N
2(g)+2H
2O (g)△H=-543kJ/mol
Ⅱ、H
2 (g)+F
2(g)=2HF (g)△H=-538kJ/mol
Ⅲ、2H
2 (g)+O
2 (g)=2H
2O (g)△H=-484kJ/mol
根据盖斯定律,Ⅰ-Ⅲ+Ⅱ×2得N
2H
4(g)+2F
2 (g)═N
2(g)+4HF (g)△H=-1135KJ/mol;
故答案为:2N
2H
4(g)+2NO
2(g)═3N
2(g)+4H
2O(g)△H=-1153.7KJ/mol;
N
2H
4(g)+2F
2 (g)═N
2(g)+4HF (g)△H=-1135KJ/mol.
点评:本题考查盖斯定律及反应热的计算,熟悉热化学反应方程式的书写与反应热的计算即可解答,难度中等,注意理解盖斯定律.

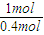 =641.625kJ,结合热化学方程式书写原则进行书写;
=641.625kJ,结合热化学方程式书写原则进行书写;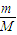 计算16g液态肼的物质的量,根据(3)中的热化学方程式,构造出生成液态水时的热化学方程式,据此计算;
计算16g液态肼的物质的量,根据(3)中的热化学方程式,构造出生成液态水时的热化学方程式,据此计算; ;
;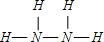 ;H-O-O-H;
;H-O-O-H;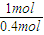 =641.625kJ,
=641.625kJ,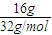 =0.5mol,完全反应生成液态水时放出的热量为0.5mol×817.625kJ/mol=408.8k,J
=0.5mol,完全反应生成液态水时放出的热量为0.5mol×817.625kJ/mol=408.8k,J
