
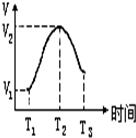
 把锌片投入到盛有稀硫酸的试管中,发现产生氢气的速率变化如图所示,其中T1~T2速率变化的主要原因是:镁条与酸的反应是放热反应,溶液温度升高,反应速率加快,T2~T3速率变化的主要原因是硫酸浓度减小,反应速率减慢.
把锌片投入到盛有稀硫酸的试管中,发现产生氢气的速率变化如图所示,其中T1~T2速率变化的主要原因是:镁条与酸的反应是放热反应,溶液温度升高,反应速率加快,T2~T3速率变化的主要原因是硫酸浓度减小,反应速率减慢.  优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氯气通入澄清石灰水,获得漂白粉 | |
| B. | 将浓盐酸和二氧化锰加热反应制备氯气 | |
| C. | 将石油分馏,直接获得乙烯、丙烯及1,3-丁二烯 | |
| D. | 将煤进行干馏,获得焦炭、煤焦油等化工原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Br-+4H++SO${\;}_{4}^{2-}$═SO2+Br2+2H2O | |
| B. | 2Fe3++SO2+2H2O═2Fe2++SO${\;}_{4}^{2-}$+4H+ | |
| C. | 2Fe2++Cl2═2Fe3++2Cl- | |
| D. | I2+SO2+2H2O═4H++SO${\;}_{4}^{2-}$+2I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ③⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用18mol/L浓硫酸配制溶解所用4mol/L的稀硫酸,玻璃仪器一般只有3种 | |
| B. | 利用Cu(OH)2替代CuO也可调试溶液pH不影响实验结果 | |
| C. | 洗涤晶体:向滤出晶体的漏斗中加少量水浸没晶体,自然流下,重复2-3次 | |
| D. | 若要用实验测定所得硫酸铜晶体中结晶水的数目要用到坩埚和坩埚钳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com