
【题目】磷的单质及其化合物用途非常广泛。回答下列问题:
(1)基态磷原子价电子轨道表示式为______________________;磷的第一电离能比硫大,其原因是_____________________________________________。
(2)已知反应6P2H4==P4+ 8PH3↑。P2H4分子中磷原子杂化类型是________________;P4分子的几何构型是________________________。
(3)N和P同主族。
①NH3的沸点比PH3高,其原因是_________________________;NH3分子中键角比PH3分子中键角大,其原因是______________________________________________。
②氮原子间可形成氮氮双键或氮氮叁键,而磷原子之间难以形成双键或叁键。从原子结构角度分析,原因是___________________________________________。
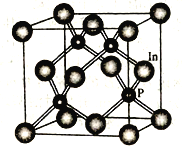
(4)磷化铟是一种半导体材料,其晶胞如下图所示,晶胞参数为a nm。In 的配位数为_______________;与In原子间距离为![]() a nm 的In 原子有________个。
a nm 的In 原子有________个。
【答案】 ![]() 磷的3P轨道处于半充满状态,较稳定 sp3 正四面体 NH3分子间可以形成氢键,PH3不能 N的电负性大于P,成键电子对偏向N,从而增加了成键电子对间的斥力,键角变大 磷的原子半径大,磷原子间形成的σ键较长,p一p轨道间肩并肩重叠程度很小或几乎不能重叠,难以形成π键 4 12
磷的3P轨道处于半充满状态,较稳定 sp3 正四面体 NH3分子间可以形成氢键,PH3不能 N的电负性大于P,成键电子对偏向N,从而增加了成键电子对间的斥力,键角变大 磷的原子半径大,磷原子间形成的σ键较长,p一p轨道间肩并肩重叠程度很小或几乎不能重叠,难以形成π键 4 12
【解析】(1)P为15号元素,P的核外电子排布式为1s22s22p63s23p3,则其价电子排布式为3s23p3,所以基态磷原子价电子轨道表示式为![]() ,磷原子最外层能级中,3p电子处于半满状态,相对比较稳定,失电子较难。答案为:
,磷原子最外层能级中,3p电子处于半满状态,相对比较稳定,失电子较难。答案为: ![]() 、磷的3P轨道处于半充满状态,较稳定
、磷的3P轨道处于半充满状态,较稳定
(2)P2H4分子中磷原子可以形成3个σ键,还有1对孤对电子,所以磷原子杂化类型是sp3杂化;在白磷中,磷原子的5个价电子中的3个形成了3个σ键,还剩下1个未成键价电子对,其非π键价层电子对总数是4,需要形成4个杂化轨道而采用sp3杂化,所以白磷分子是正四面体形结构。答案为:sp3 、正四面体
(3)①NH3和PH3为分子晶体,随着相对分子质量的增大,分子间作用力逐渐增大,熔沸点逐渐升高,但是NH3分子间可以形成氢键,PH3不能,故NH3的沸点比PH3高;N的电负性大于P,NH3中N-H键的键长比PH3中P-H键的键长要短,所以在NH3中成键电子对更靠近N,排斥力更大,以致键角更大. ②P原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,所以难以形成π键。故答案为:①NH3分子间可以形成氢键,PH3不能 、N的电负性大于P,成键电子对偏向N,从而增加了成键电子对间的斥力,键角变大 ②磷的原子半径大,磷原子间形成的σ键较长,p一p轨道间肩并肩重叠程度很小或几乎不能重叠,难以形成π键
(4)根据晶胞图可知磷化铟晶胞中:In原子数目为8×![]() +6×
+6×![]() =4,P原子数目为4,所以In的配位数为4;由于晶胞的边长为anm,设晶胞中在一个平面上处于对角线上的In原子间距离为x nm,则x2=a2+ a2,所以x=
=4,P原子数目为4,所以In的配位数为4;由于晶胞的边长为anm,设晶胞中在一个平面上处于对角线上的In原子间距离为x nm,则x2=a2+ a2,所以x=![]() anm,因此与In原子间距离为
anm,因此与In原子间距离为![]() anm的In原子有几个,也就是In原子周围与In原子处于对角线中心的In原子有几个,根据晶胞结构图可知有12个。答案为:4、 12
anm的In原子有几个,也就是In原子周围与In原子处于对角线中心的In原子有几个,根据晶胞结构图可知有12个。答案为:4、 12


科目:高中化学 来源: 题型:
【题目】酸RCOOH 和 醇R’ 18OH生成的酯为 ( )
A. RCO18OR’ B. RC18OOR’ C. R’C18OOR D. R’CO18OR
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1mol的CuSO45H2O(s)溶于水会使溶液温度降低,热效应为△H1 , 将1mol的CuSO4溶于水会使溶液温度升高,热效应为△H2;CuSO45H2O(s)受热分解的化学方程式为CuSO45H2O(s) ![]() CuSO4(s)+5H2O(l),热效应为△H3 . 则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为△H3 . 则下列判断正确的是( )
A.△H2>△H3
B.△H1<△H3
C.△H1+△H3=△H2
D.△H1+△H2>△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校合作学习小组的同学设计用甲酸钠法制取保险粉(Na2S2O4)并测定其纯度。已知保险粉易溶于水,不溶于甲醇,具有强还原性。回答下列问题:
(1)保险粉的制备。设计的实验装置如下图所示(夹持和加热装置省略):

①盛放浓硫酸的仪器名称为____________,装置A是为了制备______(填化学式)。
②装置B中发生反应的离子方程式为_____________________________________________,该反应温度需控制在70~75℃进行,适宜的加热方式是_____________,用甲醇水溶液代替水的目的是______________________________。
③装置C的作用是________________;装置D的作用是__________________________。
(2)产品中Na2S2O4的质量分数的测定,其实验步骤如下:
I.准确称取ag产品放入锥形瓶中,加入适量的水使其溶解,然后加入足量甲醛,充分反应;
II.再滴加几滴淀粉溶液,用c mol/L的标准I2溶液滴定,至终点时,消耗VmLI2溶液。
实验中涉及的反应有: Na2S2O4+2HCHO+H2O==NaHSO3·CH2O+NaHSO2·CH2O;NaHSO3·CH2O +2 I2+2H2O==NaHSO4+HCHO+4HI。
①步骤II滴定至终点的现象是_________________________________________。
②产品中Na2S2O4的质量分数为__________________________(用含a、c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H1=-akJ·mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H2=-bkJ·mol-1
③H2(g)+1/2O2(g)=H2O(g)△H3=-ckJ·mol-1
④H2(g)+1/2O2(g)=H2O(l)△H4=-dkJ·mol-1
下列叙述正确的是( )
A. 由上述热化学方程式可知△H3<△H4
B. H2的燃烧热为dkJ·mol-1
C. 4NH3(g)+4O2(g)=2NO(g)+N2(g)+6H2O(g)△H=(-a-b)kJ·mol-1
D. 4NH3(g)![]() 2N2(g)+6H2(g)△H=(6d-b)kJ·mol-1
2N2(g)+6H2(g)△H=(6d-b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如闬所示.下列说法正确的是( ) 
A.a 点所示溶液中 c(Na+)>c(A﹣)>c(H+)>c(HA)
B.a、b 两点所示溶液中水的电离程度相问
C.b点所示溶液中c(A﹣)>c(HA)
D.pH=7时,c(Na+)﹣=c(A﹣)+c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液、②HSCN溶液、③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)变化的示意图所示,下列说法正确的是( ) 
A.物质酸性的比较:CH3COOH>HSCN>H2CO3
B.反应结束后所得两溶液中,c(CH3COO﹣)>c(SCN﹣)
C.上述三种溶液中由水电离的c(OH﹣)大小:NaHCO3>CH3COOH>HSCN
D.CH3COOH溶液和NaHCO3溶液反应所得溶液中:c(CH3COO﹣)+c(CH3COOH)=0.10molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由阿伏伽德罗常数(NA)和一个水分子的质量(m水)、一个水分子的体积(V水),不能确定的物理量有( )
A.1摩尔水的质量
B.1摩尔水蒸气的质量
C.1摩尔水的体积
D.1摩尔水蒸气的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(气体体积已折算为标准状况下的体积)。下列分析正确的是

A. OE段表示的平均速率最快
B. EF段,用盐酸表示该反应的平均反应速率为0.4mol/(L·min)
C. OE、EF、FG三段中,用二氧化碳表示该反应的平均反应速率之比为2:6:7
D. G点CO2不再增加的原因可能是盐酸的浓度过低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com