
分析 (1)该溶液中存在弱电解质水和醋酸的电离、醋酸根离子盐类水解;
(2)0.01molCH3COONa和0.002molHCl溶于水得到0.008molCH3COONa、0.002molCH3COOH、0.002molNaCl,CH3COONa、NaCl为强电解质,CH3COOH为弱电解质,根据钠离子、氯离子的物质的量来分析;
(3)①溶液中存在物料守恒,钠元素和醋酸、醋酸根离子综合相等;
②溶液中存在醋酸钠溶液的组成,得知阴阳离子是1:1,但阴离子弱离子要水解成弱电解质分子,根据电荷守恒判断.
解答 解:(1)存在水的电离平衡、醋酸的电离平衡、醋酸根离子的水解平衡,分别为CH3COO-+H2O?CH3COOH+OH-、H2O?H++OH-、CH3COOH?CH3COO-+H+,
故答案为:CH3COO-+H2O?CH3COOH+OH-;H2O?H++OH-;
(2)0.01molCH3COONa和0.002molHCl溶于水得到0.008molCH3COONa、0.002molCH3COOH、0.002molNaCl,CH3COONa、NaCl为强电解质,CH3COOH为弱电解质,则溶液中存在的离子为:Na+、H+、Cl-、OH-、CH3COO-,存在的分子为:H2O、CH3COOH,即共有7种不同的微粒,已知0.01mol CH3COONa,则浓度为0.01mol•L-1的是Na+,HCl为0.002mol,则浓度为0.002mol•L-1的是Cl-,
故答案为:7;Na+;Cl-;
(3)①已知0.01mol CH3COONa,则浓度为0.01mol•L-1的是Na+,由物料守恒可知:c(Na+)=c(CH3COOH)+c(CH3COO- )=0.01mol/L,故答案为:0.01;
②根据电荷守恒可知,c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(CH3COO- ),故答案为:c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(CH3COO-).
点评 本题考查溶液中的微粒及电荷守恒、物料守恒,明确混合溶液中的溶质、电解质的强弱、原子守恒、电荷守恒是解答本题的关键,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 电解MgCl2溶液可获得金属镁 | |
| B. | 溶液与胶体:本质区别是能否发生丁达尔效应 | |
| C. | 常温下可以用铝或铁制容器贮存浓硝酸和浓硫酸 | |
| D. | 用焰色反应鉴别NaCl溶液和Na2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| B. | NaHSO3溶液中通入少量Cl2:HSO3-+Cl2+H2O═3H++SO42-+2Cl- | |
| C. | 氯化钠与浓硫酸混合加热:H2SO4+2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+Cl2↑+H2O | |
| D. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
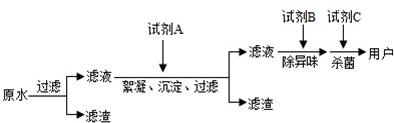
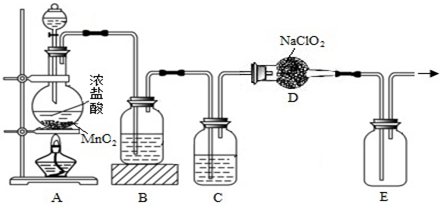
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
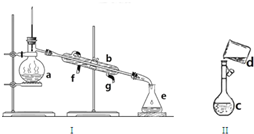 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
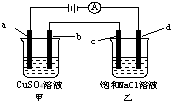 如图所示,a、b、c均为石墨电极,d为碳钢电极,通电电解一段时间.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电电解一段时间.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )| A. | 甲、乙两烧杯中溶液的pH均保持不变 | |
| B. | 当b极增重3.2 g时,d极产生的气体为0.56 L(标准状况) | |
| C. | 当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀 | |
| D. | 甲烧杯中a电极反应式为:4OH--4e-═O2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com