
【题目】某兴趣小组的同学设计实验制备CuBr(白色结晶性粉末,微溶于水,不溶于乙醇等有机溶剂),实验装置(夹持、加热仪器略)如图所示。
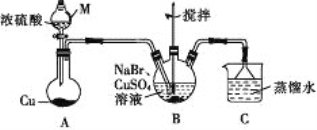
(1)若将M中的浓硫酸换成70%的H2SO4,则圆底烧瓶中的固体试剂为____(填化学式)。
(2)B中发生反应的化学方程式为_____,能说明B中反应已完成的依据是_____。若B中Cu2+仍未完全被还原,适宜加入的试剂是____(填标号)。
A.液溴 B.Na2SO4 C.铁粉 D.Na2S2O3
(3)下列关于过滤的叙述不正确的是___(填标号)。
a.漏斗末端颈尖可以不紧靠烧杯壁 b.将滤纸润湿,使其紧贴漏斗内壁
c.滤纸边缘可以高出漏斗口 d.用玻璃棒在漏斗中轻轻搅动以加快过滤速率
(4)洗涤时,先用装置C中的吸收液清洗,其目的是______,再依次用溶解SO2的乙醇、乙醚洗涤的目的是______。
【答案】Na2SO3 2CuSO4+2NaBr+SO2+2H2O=2CuBr↓+Na2SO4+2H2SO4 溶液蓝色褪去 D acd 防止CuBr被氧化 用乙醇除去固体表面的水,再用更易挥发的乙醚除去乙醇,使其快速干燥
【解析】
(1)装置A中,Cu与浓硫酸反应制取二氧化硫,70%的H2SO4可与Na2SO3固体反应生成二氧化硫;
(2)由题知B装置中硫酸铜、溴化钠、水和SO2反应生成CuBr,铜元素被二氧化硫还原,SO2自身被氧化为SO42,据此写出方程式;硫酸铜溶液显蓝色,实验完成时蓝色的铜离子全部转化为CuBr;Na2S2O3与生成的硫酸反应可生成二氧化硫,继续还原Cu2+;
(3)a. 漏斗末端颈尖要紧靠烧杯内壁,防止液体溅出,故错误;
b. 将滤纸润湿,使其紧贴漏斗内壁,防止存在气泡,保证过滤顺利进行;
c. 滤纸边缘要低于漏斗口,防止滤液渗出造成滤液损失;
d. 用玻璃棒在漏斗中轻轻搅动,容易使滤纸破损;
(4)装置C中的吸收液含有SO2,根据SO2的还原性分析;再依次用溶解SO2的乙醇、乙醚洗涤的目的是用乙醇除去固体表面的水,再用更易挥发的乙醚除去乙醇,使其快速干燥。
(1)装置A中,Cu与浓硫酸反应制取二氧化硫,70%的H2SO4可与Na2SO3固体反应生成二氧化硫;
故答案为:Na2SO3;
(2)由题知B装置中硫酸铜、溴化钠、水和SO2反应生成CuBr,铜元素被二氧化硫还原,SO2自身被氧化为SO42,发生反应的化学方程式为2CuSO4+2NaBr+SO2+2H2O=2CuBr↓+Na2SO4+2H2SO4;硫酸铜溶液显蓝色,实验完成时蓝色的铜离子全部转化为CuBr,则能说明B中反应已完成的依据是溶液蓝色褪去;Na2S2O3与生成的硫酸反应可生成二氧化硫,继续还原Cu2+;
故答案为:2CuSO4+2NaBr+SO2+2H2O=2CuBr↓+Na2SO4+2H2SO4;溶液蓝色褪去;D;
(3)a. 漏斗末端颈尖要紧靠烧杯内壁,防止液体溅出,故错误;
b. 将滤纸润湿,使其紧贴漏斗内壁,防止存在气泡,保证过滤顺利进行,故正确;
c. 滤纸边缘要低于漏斗口,防止滤液渗出造成滤液损失,故错误;
d. 用玻璃棒在漏斗中轻轻搅动,容易使滤纸破损,故错误;
故答案为:acd;
(4)装置C中的吸收液含有SO2,溴化亚铜易被氧化,SO2有还原性,可以防止CuBr被氧化;再依次用溶解SO2的乙醇、乙醚洗涤的目的是用乙醇除去固体表面的水,再用更易挥发的乙醚除去乙醇,使其快速干燥;
故答案为:防止CuBr被氧化;用乙醇除去固体表面的水,再用更易挥发的乙醚除去乙醇,使其快速干燥。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】四硼酸钠的阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示。下列说法错误的是( )
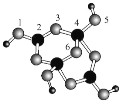
A.元素的第一电离能:O>H>B
B.在Xm-中,硼原子轨道的杂化类型有sp2和sp3
C.配位键存在于4、5原子之间和4、6原子之间
D.m=2,NamX的化学式为Na2B4O5(OH)4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ga)与铝同主族,曾被称为“类铝”,其氧化物、氢氧化物均为两性化合物。工业制备镓的流程如图所示。下列判断不合理的是( )
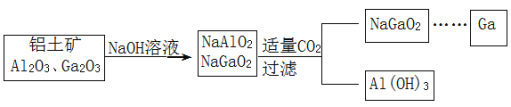
A.Al、Ga均处于ⅢA族
B.Ga(OH)3可与NaOH反应生成 NaGaO2
C.酸性:Al(OH)3>Ga(OH)3
D.Ga2O3可与盐酸反应生成GaCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香叶醇、橙花醇和乙酸橙花酯在工业上用作香料,它们可由月桂烯来合成。
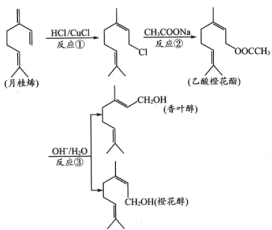
下列说法正确的是
A.反应①②③均为取代反应
B.月桂烯分子中所有碳原子全部处在同一平面上
C.香叶醇和橙花醇具有相同的分子式
D.乙酸橙花酯可以发生取代、加成、氧化和聚合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期主族元素X、Y、M、N的信息如下:
有关信息 | |
X | X元素的原子最外层电子数是电子层数的3倍 |
Y | Y元素所在主族序数与周期序数之差为4,Y是同周期中原子半径最小的元素 |
M | 常温下单质呈液态的非金属元素 |
N | N的化合物在灼烧时焰色呈黄色 |
请回答下列问题:
(1)M元素在周期表中的位置______________________。
(2)Y元素的简单阴离子结构示意图_______________。
(3)化合物N2X2的电子式为_______________,试写出它的一种用途_______________。
(4)设计方案证明M、Y元素的得电子能力强弱:______________________________________。
(5)Y的单质是一种重要的化工原料,在工农业生产、生活中有着重要的应用。为探究Y单质的性质,某同学设计了如图所示的实验装置。
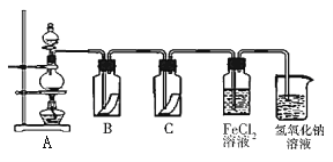
①实验中制取气体的化学方程式为:__________________________________________,该反应中氧化剂和还原剂的物质的量之比为_________________________
②装置B、C中依次放的是干燥的红色布条和湿润的红色布条,理论上装置_____中的红色布条褪色,但实验过程中该同学发现装置B、C中的布条均褪色,其原因可能是_________________。
③写出该气体与FeCl2溶液反应的离子方程式____________________________________。
④工业上常用石灰乳吸收制该气体制得漂白粉,漂白粉的必须密封保存,否则易失效,原因是____(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.FeO与稀硝酸反应属于复分解反应
B.常温下Fe与浓硝酸不反应
C.铜片与浓硝酸发生离子反应:Cu+NO3-+4H+=Cu2++NO2↑+2H2O
D.向Fe(NO3)2稀溶液中加入盐酸发生反应:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅢA族元素及某些常见非金属元素的化合物在晶体材料等方面的用途非常广泛。回答下列问题:
(1)写出基态Ga原子的价电子轨道表示式__________________
(2)NH4HF2中HF2-的结构为F-H···F-,则NH4HF2中含有的化学键有_________
A.离子键 B.共价键 C.金属键 氢键 E.配位键
(3)CH3OH分子中的键角:H-C-H_______H-O-C。(填“<”、“>”、“=”)
(4)B、Al、Ga单质的熔点依次为2300°C,660°C,29.8°C,解释熔点产生差异的原因:___________________
(5)黑磷是磷的一种同素异形体,与石墨烯类似,其晶体结构片段如图所示:其中最小的环为____元环,每个环平均含有____个P原子。

(6)铊化钠(NaTl)可看作是由两个金刚石晶格穿插得到的(如图),已知晶胞参数为a pm。
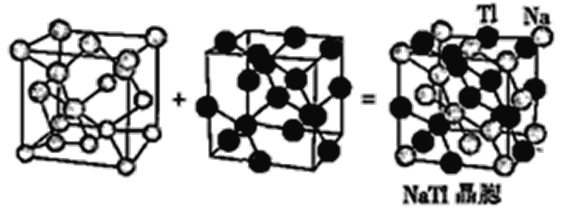
①铊化钠中Tl-Tl间最小距离为__________pm。
②设阿伏加德罗常数的值为NA,则NaTl的密度是________g·cm-3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是六种短周期元素的原子半径及主要化合价(已知铍元素的原子半径为0.089 nm)。
元素代号 | A | B | C | D | X | Y |
原子半径/nm | 0.037 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
主要化合价 | +1 | +3 | +6,-2 | -1 | -2 | +5,-3 |
(1)C元素在周期表中的位置为________,其离子结构示意图为:_______。
(2)B的最高价氧化物对应的水化物与Y的最高价氧化物对应的水化物反应的离子方程式为___。
(3)关于C、D 两种元素说法正确的是__________(填序号)。
a.简单离子的半径D>C b.气态氢化物的稳定性D比C强 c.最高价氧化物对应的水化物的酸性C比D强
(4)在100mL18mol/L的C的最高价氧化物对应的水化物的浓溶液中加入过量的铜片,加热使其充分反应,产生气体的体积为6.72L(标况下),则该反应过程中转移的电子数为______。
(5)写出由A、D、X三种元素组成的某种可以消毒杀菌物质的电子式_____________。
(6)比较Y元素与其同族短周期元素的氢化物的熔沸点高低__ >___ (填氢化物化学式),理由___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com