
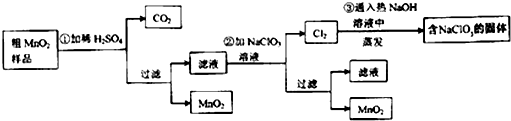
分析 由制备流程可知,MnO2不溶于硫酸,样品中的MnCO3和硫酸反应生成可溶性的MnSO4,滤液中含MnSO4,第②步发生5MnSO4+2NaClO3+4H2O=5MnO2↓+Cl2↑+Na2SO4+4H2SO4,第③步中发生氯气与热的NaOH发生氧化还原反应生成NaCl、NaClO3、水,溶液蒸发可得到固体.
(1)MnO2不溶于硫酸,样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4;
(2)Mn元素的化合价升高,Cl元素的化合价降低,结合电子、电荷守恒分析;
(3)蒸发需要蒸发皿、玻璃棒、酒精灯等;Cl2通入热的NaOH溶液中一定发生氧化还原反应,NaClO3属于氧化产物,因此一定有还原产物NaCl;
(4)由工艺流程图可以看出,循环利用的是H2SO4和NaClO3;
(5)碱性锌锰电池放电时,负极上Zn失去电子;
(6)CO2的物质的量为$\frac{0.672L}{22.4L/mol}$=0.03mol,则MnCO3的物质的量为0.03mol,质量为115g/mol×0.03mol=3.45g,所以MnO的质量为42.33g-26.1g-3.45g=12.78g,其物质的量为$\frac{12.78g}{71g/mol}$=0.18mol,结合5MnSO4+2NaClO3+4H2O=5MnO2+Cl2↑+Na2SO4+4H2SO4计算需要NaClO3的物质的量.
解答 解:(1)MnO2不溶于硫酸,所以加稀硫酸时样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4,所以粗MnO2样品中的MnO和MnCO3转化为可溶性物质,
故答案为:MnO和MnCO3;
(2)MnSO4要转化为MnO2,需失去电子,故需要加入NaClO3做氧化剂,依据得失电子守恒可以配平,所以反应的化学方程式是:5MnSO4+2NaClO3+4H2O=5MnO2↓+Cl2↑+Na2SO4+4H2SO4,因此反应的离子方程式是5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+,
故答案为:5Mn2+;2;4H2O;5;1;8H+;
(3)蒸发需要蒸发皿、玻璃棒、酒精灯等;Cl2通入热的NaOH溶液中一定发生氧化还原反应,NaClO3属于氧化产物,因此一定有还原产物NaCl,
故答案为:玻璃棒;蒸发皿;酒精灯;NaCl;
(4)由工艺流程图可以看出,循环利用的是H2SO4和NaClO3,故答案为:NaClO3;
(5)碱性锌锰电池放电时,负极上Zn失去电子,负极反应为Zn-2e-+2OH-=Zn(OH)2,故答案为:Zn-2e-+2OH-=Zn(OH)2;
(6)CO2的物质的量为$\frac{0.672L}{22.4L/mol}$=0.03mol,则MnCO3的物质的量为0.03mol,质量为115g/mol×0.03mol=3.45g,所以MnO的质量为42.33g-26.1g-3.45g=12.78g,其物质的量为$\frac{12.78g}{71g/mol}$=0.18mol,因此与稀硫酸反应时共生成MnSO4的物质的量为0.18mol+0.03mol=0.21mol,根据方程式5MnSO4+2NaClO3+4H2O=5MnO2+Cl2↑+Na2SO4+4H2SO4,则需要NaClO3的物质的量为0.21mol×$\frac{2}{5}$=0.084mol,
故答案为:0.084.
点评 本题考查物质的制备实验,为高频考点,把握流程中发生的化学反应及混合物分离方法为解答的关键,侧重分析能力及推断、计算能力的考查,综合性较强,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=185.57 kJ•mol-1能自发进行,是因为体系有自发地向混乱度增大的方向转变的倾向 | |
| B. | 能自发进行的反应一定能迅速发生 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独做为判断反应能否自发进行的判据 | |
| D. | CaCO3(s)═CaO(s)+CO2(g)△H>0,△S>0,不论在何种条件下都可能自发 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化碳的捕捉和利用是能源领域的一个重要战略方向.
二氧化碳的捕捉和利用是能源领域的一个重要战略方向.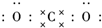 ,所含化学键的类型是共价键.
,所含化学键的类型是共价键.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
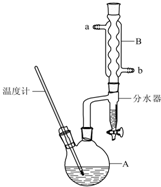 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:| 相对分子质量 | 沸点/℃ | 密度/g•cm3 | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 待测食醋的体积初读数/mL | 0.02 | 0.03 | 0.00 |
| 待测食醋的体积终读数/mL | 25.01 | 25.04 | 25.02 |
| 氢氧化钠标准液的体积初读数/mL | 0.01 | 0.03 | 0.04 |
| 氢氧化钠标准液的体积终读数/mL | 12.52 | 12.55 | 12.58 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
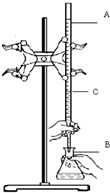 在实验室用已知浓度的盐酸滴定某未知浓度的NaOH溶液,装置和操作如右图所示.请回答:
在实验室用已知浓度的盐酸滴定某未知浓度的NaOH溶液,装置和操作如右图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向盐酸中滴加氨水:H++OH-═H2O | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com