
| A. | 非金属元素只能形成共价化合物 | |
| B. | 在NaCl中,除Na+和Cl-的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用 | |
| C. | 任何离子键在形成过程中必定有电子的得与失 | |
| D. | 离子化合物可能含有共价键原子核之间的排斥作用 |
分析 A、铵盐全部为非金属元素;
B、在NaCl中存在离子、电子、质子,既有静电吸引作用,又有电子与电子、原子核与原子核之间的排斥作用;
C.离子键的形成过程中不一定有电子得失;
D、过氧化钠中含有共价键的离子化合物,存在原子核之间的排斥力.
解答 解:A、铵盐全部为非金属元素,为离子化合物,故A错误;
B、在NaCl中存在离子、电子、质子,既有静电吸引作用,又有电子与电子、原子核与原子核之间的排斥作用,故B正确;
C.离子键的形成过程中不一定有电子得失,如复分解反应中离子键的形成,故C错误;
D、过氧化钠中含有共价键的离子化合物,存在原子核之间的排斥力,故D正确;
故选AC.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,注重基础知识的考查,注意常见物质中的化学键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 铝在空气中耐腐蚀,所以铝是不活泼金属 | |
| B. | 点燃的镁条插入盛有二氧化碳的集气瓶里,则迅速熄灭 | |
| C. | 铝在高温下能还原锰、铁、铬等金属的氧化物 | |
| D. | 因为镁和铝在空气中都能形成氧化膜,所以镁和铝都不溶于浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素电负性:P>F | B. | 第一电离能(I1):P(磷)>Se(硒) | ||
| C. | 离子半径:Cl-<K+ | D. | 熔沸点:MgCl2<AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35Cl原子所含质子数为18 | |
| B. | $\frac{1}{18}$mol的1H35Cl分子所含中子数约为6.02×1023 | |
| C. | 气体35Cl2的摩尔质量为70 | |
| D. | 3.5g的气体35Cl2的体积为2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①② | B. | ③④ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
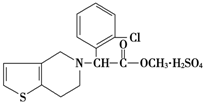 波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来希望.波立维属于硫酸氢盐,它的结构如图所示.下列关于它的说法正确的是( )
波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来希望.波立维属于硫酸氢盐,它的结构如图所示.下列关于它的说法正确的是( )| A. | 该物质的化学式为C16H15ClNO2•H2SO4 | |
| B. | 该物质不溶于水 | |
| C. | 波立维属于硫酸氢盐,它的形成与其结构中的氮原子有关 | |
| D. | 它可以与NaOH溶液反应,1 mol该物质最多可消耗2 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
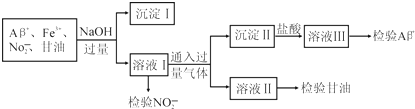
| A. | 通入的过量气体可能是CO2 | |
| B. | 分离出沉淀Ⅰ的操作名称是过滤,利用沉淀Ⅰ可检验出Fe3+ | |
| C. | 若向溶液Ⅲ中先加足量NH4F后再加氨水可以检验Al3+ | |
| D. | 用酸性KI溶液检验NO2-离子的离子方程式为2NO2-+2I-+4H+═2NO+I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合c(H+)+c(M+)=c(OH-)+c(A-) | |
| B. | Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| C. | 室温下pH=7的CH3COOH与CH3COONa的混合液中离子的浓度大小顺序为:c(Na+)=c(CHCOO-)>c(H+)=c(OH-) | |
| D. | pH=4的NaHA溶液:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com