
| �¶ȣ��棩 ������Ũ�� ��mol/L�� ʱ�䣨min�� | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 9��10-3 | 2.7��10-2 | 8.1��10-2 |
| t2 | 3��10-2 | 4.8��10-2 | 9.4��10-2 |
| t3 | 3��10-2 | 4.8��10-2 | 9.4��10-2 |

���� ��1��a����������ǹ���ת���ɻ�ѧ�ܣ�
b����ʯȼ���Dz���������
c����ʯȼ��ת��Ϊ������̼��ѭ��������������ԭ��Ӧ��
d���ѽ��Ŀ����Ϊ�˻����ϩ����ϩ������ϩ����ϩ����Ȳ�ȣ�������ʯ���к���ϩ����ϩ��
��2������G=��H-T•��S��0ʱ����Ӧ���Է����У�
��3�����ݸ�˹���ɣ������֪�Ȼ�ѧ����ʽ��������⣻�������Է�����Ӧ��Ҫ�������жϣ�
��4�����ݱ����¶ȶ����������Ũ�ȵ�Ӱ����������ݱ������������ӦNH2COONH4��s��?2NH3��g��+CO2��g����ƽ�ⳣ�����������������ӦNH2COONH4��s��?2NH3��g��+CO2��g����֪��c��NH3��=3��10-2��$\frac{2}{3}$=2��10-2mol/L��c��CO2��=3��10-2��$\frac{1}{3}$=1��10-2mol/L��
��5���������϶�����̼�õ���������ϩ��������缫��ӦʽΪ��2CO2+12H++12e-=CH2=CH2+4H2O��
��� �⣺��1��a����������ǹ���ת���ɻ�ѧ�ܣ�����ȷ��
b����ʯȼ���Dz��������ģ��ʴ���
c����ʯȼ��ת��Ϊ������̼��ѭ��������������ԭ��Ӧ������ȷ��
d���ѽ��Ŀ����Ϊ�˻����ϩ����ϩ������ϩ����ϩ����Ȳ�ȣ�������ʯ���к���ϩ����ϩ���ʴ���
��ѡ��ac��
��2��2CO2��g����2CO��g��+O2��g������Ӧ���������ʵ�����������Ҷ�������S��0��һ�������¿�ֱ�ӹ���ֽ�CO2������Ӧ����G=��H-T•��S��0ʱ����Ӧ���Է����У���÷�Ӧ��H��0��
�ʴ�Ϊ������
��3��������⣺��2H2O��l���T2H2��g��+O2��g����H=+571.5kJ•mol-1
H2��CO2��Ϸ�Ӧ����3H2��g��+CO2��g���TCH3OH��l��+H2O��l����H=-137.8kJ•mol-1
���ݸ�˹���ɣ��Ѣ١�3+�ڡ�2�÷���4H2O��l��+2CO2��g����2CH3OH��l��+3O2��g����H=571.5��3+��-137.8����2=1438.9kJ•mol-1���������Է�����Ӧ��Ҫ��������֪��Ҫ����ļ��������У�������Ч��������������ȡ����ӷ�Ӧ��ϵ����Ч���룬����CO2��ϴ�ת����
�ʴ�Ϊ��+1438.9��ab��
��4���ӱ������ݿ��Կ����������¶����ߣ��������Ũ������ƽ�������ƶ�����÷�ӦΪ���ȷ�Ӧ���������������ӦNH2COONH4��s��?2NH3��g��+CO2��g����֪��c��NH3��=3��10-2��$\frac{2}{3}$=2��10-2mol/L��c��CO2��=3��10-2��$\frac{1}{3}$=1��10-2mol/L������K=c2��NH3����c��CO2��=��2��10-2mol��2��1��10-2=4��10-6��
�ʴ�Ϊ�����ȣ�4��10-6��
��5���������϶�����̼�õ���������ϩ��������缫��ӦʽΪ��2CO2+12H++12e-=CH2=CH2+4H2O���ʴ�Ϊ��2CO2+12H++12e-=CH2=CH2+4H2O��
���� ���⿼���˸�˹���ɵ�Ӧ�ã���Ӧ���ʸ������㣬��ѧƽ�⡢��ѧƽ�ⳣ���ĸ������㣬�Լ��жϷ�Ӧ���ʱ䡢�ر䣬�缫����ʽ����д�����֪ʶ�����⣬Ҫ��������ͼ�����������ݷ����жϣ����ա���ȡ��Ч��Ϣ��ͻ���˻�ѧ��Ϣ���������Ŀ��飬��Ŀ�ѶȽϴ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
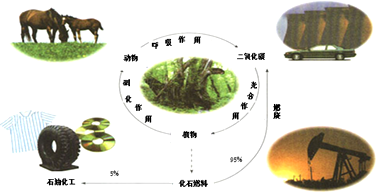
 25��ʱijЩ����ĵ���ƽ�ⳣ�����±���ʾ��
25��ʱijЩ����ĵ���ƽ�ⳣ�����±���ʾ��| CH3COOH | HClO | H2CO3 |
| K��CH3COOH�� =1.8��10-5 | K��HClO�� =3.0��10-8 | K��H2CO3��a1=4.4��10-7 K��H2CO3��a2=4.7��10-11 |
| A�� | ��ͬŨ�ȵ�CH3COOH��HClO�Ļ����Һ�У�������Ũ�ȵĴ�С��ϵ�ǣ�c��H+����c��ClO-����c��CH3COO-����c��OH-�� | |
| B�� | ͼ����a��c������������Һ��$\frac{c��{R}^{-}��}{c��HR��•c��O{H}^{-}��}$��ȣ�HR����CH3COOH��HClO�� | |
| C�� | ͼ����a�����Ũ�ȴ���b�����Ũ�� | |
| D�� | ��NaClO��Һ��ͨ������������̼�����ӷ���ʽΪ��2ClO-+CO2+H2O=2HClO+CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
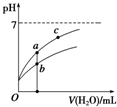
| A�� | ͨ������ĵ缫Ϊ���� | |
| B�� | ��װ����Fe�缫�ķ�ӦΪFe-3e-=Fe3+ | |
| C�� | Ϊ��ʹ��ȼ�ϵ�س�ʱ���ȶ����У���صĵ�������Ӧ�����ȶ�����ع���ʱ��ѭ������ΪCO2 | |
| D�� | ����װ������1.6 g CH4�μӷ�Ӧ����C�缫���������������ڱ�״����Ϊ8.96 L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Fe203������Һ��ͨ��HI��Fe203+6H+�T2Fe3++3H20 | |
| B�� | 1 mol/L NaAl02��Һ��1.5 mol/L HC1��Һ�������ϣ�6AlO2-+9H++3H2O�T5A1��OH��3+Al3+ | |
| C�� | ��Ca�� Cl0��2��Һ��ͨ��S02��Ca2++2ClO-+S02+H20�TCaSO3+2HC1O | |
| D�� | ��0.1 mol/LpH=l��NaHA��Һ�м���NaOH��Һ��HA-+OH-�TH2O+A2- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
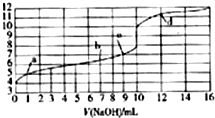
| A�� | HAΪһԪǿ�� | |
| B�� | ˮ�ĵ���̶ȣ�a�㣾b�㣾c�� | |
| C�� | c��ʱ����ͼ�ǡ����ȫ��Ӧ | |
| D�� | d��ʱ����Һ������Ũ�ȣ�c��Na+����c��A-����c��OH-����c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �٢ۢ� | C�� | �ڢۢ� | D�� | �٢ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ����ȼ�ϵ�ؿ���ʹ���ں���ɻ��ϣ��䷴Ӧԭ��ʾ��ͼ��ͼ�������й�����ȼ�ϵ�ص�˵������ȷ���ǣ�������
����ȼ�ϵ�ؿ���ʹ���ں���ɻ��ϣ��䷴Ӧԭ��ʾ��ͼ��ͼ�������й�����ȼ�ϵ�ص�˵������ȷ���ǣ�������| A�� | �õ���е缫b������ | |
| B�� | ���·�е����ɵ缫bͨ����������缫a | |
| C�� | �õ�ص�������ӦΪO2+4H++4e-=2H2O | |
| D�� | �õ�ص��ܷ�Ӧ��2H2+O2=2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �ڢ� | C�� | �ۢܢ� | D�� | �ۢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
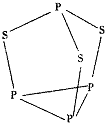 ���������ǻ���ɫ��״�ᾧ����ṹ��ͼ��ʾ����������ˮ�����ڵ����ᡢ����̼�������л��ܼ����ڷ��ڵ�NaOHϡ��Һ�л�Ѹ��ˮ�⣮�ش��������⣺
���������ǻ���ɫ��״�ᾧ����ṹ��ͼ��ʾ����������ˮ�����ڵ����ᡢ����̼�������л��ܼ����ڷ��ڵ�NaOHϡ��Һ�л�Ѹ��ˮ�⣮�ش��������⣺�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com