
����Ŀ��һ���¶��£��������ݻ���Ϊ2.0L�ĺ����ܱ������з�����Ӧ��2NO��g��+2CO��g��N2��g��+2CO2��g��
����������ʼ���ʵ����뷴Ӧ�¶����±���ʾ����Ӧ�����мס���������CO2�����ʵ�����ʱ��仯��ϵ����ͼ��ʾ��
���� | �¶�/�� | ��ʼ���ʵ���/mol | |
NO ��g�� | CO ��g�� | ||
�� | T1 | 0.20 | 0.20 |
�� | T1 | 0.30 | 0.30 |
�� | T2 | 0.20 | 0.20 |
����˵����ȷ���ǣ� ��
A.�÷�Ӧ������ӦΪ���ȷ�Ӧ
B.�ﵽƽ��ʱ������CO2����������ȼ��е�С
C.T1��ʱ������ʼʱ����г���0.40 mol NO��0.40mol CO��0.40mol N2��0.40mol CO2 �� ��Ӧ�ﵽ��ƽ��ǰv��������v���棩
D.T2��ʱ������ʼʱ����г���0.06mol N2��0.12 mol CO2 �� ���ƽ��ʱN2��ת���ʴ���40%
���𰸡�D
���������⣺A.2NO��g��+2CO��g��N2��g��+2CO2��g�����ȹ���ƽ�¶ȸߣ���״̬�¶ȸ��ڱ���T1��T2 �� ��ʱ��ƽ��״̬������̼���ʵ���С��˵���¶�Խ��ƽ��������У��淴ӦΪ���ȷ�Ӧ������ӦΪ���ȷ�Ӧ����A����
B�����п��Կ����Ǽ���ʼ���ﵽƽ��״̬���ټ���0.1molNO��0.1molCO���൱������ƽ��ѹǿ��ƽ��������У��ﵽƽ��ʱ������CO2����������ȼ��еĴ�B����
C����״̬��ƽ��ʱCO���ʵ���Ϊ0.10mol��������м������ƽ�ⳣ����
2NO��g��+ | 2CO��g�� | N2��g��+ | 2CO2��g�� | |||
��ʼ����mol/L�� | 0.1 | 0.1 | 0 | 0 | ||
�仯����mol/L�� | 0.05 | 0.05 | 0.025 | 0.05 | ||
ƽ������mol/L�� | 0.05 | 0.05 | 0.025 | 0.05 |
K= ![]() =10��
=10��
T1��ʱ������ʼʱ����г���0.40 mol NO��0.40mol CO��0.40mol N2��0.40mol CO2 �� Qc= ![]() =2.5��K=10����Ӧ�ﵽ��ƽ��ǰv��������v���棩����C����
=2.5��K=10����Ӧ�ﵽ��ƽ��ǰv��������v���棩����C����
D��T2��ʱ��ƽ��״̬CO���ʵ���Ϊ0.12mol��
2NO��g��+ | 2CO��g�� | N2��g��+ | 2CO2��g�� | ||
��ʼ����mol�� | 0.2 | 0.2 | 0 | 0 | |
ת������mol�� | 0 | 0 | 0.1 | 0.2 | |
�仯����mol�� | 0.08 | 0.08 | 0.04 | 0.08 | |
ƽ������mol�� | 0.12 | 0.12 | 0.04 | 0.08 |
2NO��g��+ | 2CO��g�� | N2��g��+ | 2CO2��g�� | |||
��ʼ����mol�� | 0 | 0 | 0.06 | 0.12 | ||
ת���� | 0.12 | 0.12 | 0 | 0 |
����ʼʱ����г���0.06mol N2��0.12 mol CO2 �� ��Ӧ������еõ�ƽ��״̬������ʼ��Ϊ0.12molNO��0.12molCO�ﵽ��ƽ����ͬ������ʼ��0.2molCO��NO��ȣ��൱�ڼ�����NO��CO0.08mol��CO��NO��ѹǿ��Сƽ��������У����Ե���ת���ʴ���40%����D��ȷ��
��ѡD��
�����㾫����������Ŀ����֪���������û�ѧƽ��״̬���ʼ����������֪ʶ���Եõ�����Ĵ𰸣���Ҫ���ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����


 ��ʦ�㲦��ϵ�д�
��ʦ�㲦��ϵ�д� Ӣ�żƻ���ĩ����ϵ�д�
Ӣ�żƻ���ĩ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���õ����ز�����ͭ��װ��ͼ��ʾ�˹����ϵͳ�����ø�װ�óɹ���ʵ������CO2��H2O�ϳ�CH4������˵������ȷ����

A. �ù����ǽ�̫����ת��Ϊ��ѧ�ܵĹ���
B. GaN���淢��������Ӧ��2H2O��4 e��=== O2����4H��
C. Cu����ķ�Ӧ�ǣ�CO2��8e����6H2O === CH4��8OH
D. H+�����ӽ���Ĥ��������Ǩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ����
A����ѧʵ�����е����Ǵ��Ⱥܸߣ���������ʳ��
B��ʵ��������ȡ���ж����壬����ͨ�缴��
C��ʵ�������ù��ķ�ϴҺ������������ϴ����
D���������ֽӴ�ҩƷ����Ҫ�ѱǿ״յ�������ȥ��ҩƷ����ζ�����ó��κ�ҩƷ��ζ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е��뷽��ʽ����ȷ���ǣ� ��
A.NaHSO4����ˮ��NaHSO4Na++H++SO42��
B.��������룺HClO�TClO��+H+
C.HF����ˮ��HF+H2OH3O++F��
D.NH4Cl����ˮ��NH4++H2ONH3H2O+H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijЩ�������ijɷ��к����������������ڷ��û������������ʡ��������������Ƿ���ʵ��Լ���
A. ϡ���� B. ʯ����Һ C. KSCN��Һ D. ��ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaClO2��һ����Ҫ��ɱ����������Ҳ������Ư��֯��ȣ���һ������������ͼ���ش��������⣺ 
��1��ClO2�ķе�Ϊ283K����ClO2�ֽⱬը��һ����ϡ����������ϡ�͵�10%���¸���ȫ��д������Ӧ������������ClO2�Ļ�ѧ����ʽ ��
��2����β�����ա������ա���⡱�����ų�������ClO2 ��
����β�����չ����У��ɴ���H2O2���Լ���������ţ���
A��Na2O2B��Na2S C��FeCl2D��KMnO4
�����β��������Ч�ʵĿ��д�ʩ��������ţ���
A��β������ʱ��ֽ�������ҺB���ʵ��ӿ�β����ͨ������C�����¶ȿ�����20������D����ˮϡ��β������Һ
�۴����շ�Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ ��
��3���ڼ�����Һ��NaClO2�Ƚ��ȶ�����������Һ�У�ClO2����H+��ΪHClO2 �� HClO2
��Ψһ����±�ᣬ���ȶ����ֽ����Cl2��ClO2��H2O��д��HClO2�ֽ�Ļ�ѧ����ʽ�� ��
��4����֪NaClO2���ܽ�����¶����߶�����NaClO2������Һ��38������60�����»�����NaClO2 �� ��NaClO2���������п��ܻ��е����������ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڻ�ѧ��ӦA��g��+3B��g��2C��g��+D��g���У������ʵ�ƽ����Ӧ���ʼ�Ĺ�ϵʽ��ȷ���ǣ� ��
A.vA=vB
B.vA=2vC
C.3vB=vC
D.vB=3vD
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���F��һ�����ƹؽ���ֹʹҩ���ϳ�F��һ�ִ�ͳ��·����ͼ�� 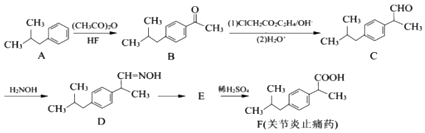
��֪���� ![]() ����
���� ![]() �� ��
�� �� ![]() ��
��
��1��B�к��������ŵ�����Ϊ ��
��2����֪D������Ӧ������E��E�ķ���ʽC13H17N��д��E�Ľṹ��ʽ ��
��3��A��B�ķ�Ӧ����Ϊ��A��B�ķ�Ӧ����ʽΪ ��
��4��д��ͬʱ��������������F��һ��ͬ���칹��Ľṹ��ʽ����дһ�֣���
���ܷ���������Ӧ�����ܷ���ˮ�ⷴӦ����ˮ�����֮һ����FeCl3��Һ������ɫ��Ӧ���۷�����ֻ��4�ֲ�ͬ��ѧ�������⣮
��5���ϳ�F�� ![]() ����һ�ָ���������2������1��������
����һ�ָ���������2������1�������� ![]() ��������
��������
������[��CH3CO��2O]Ϊԭ�����ϳɣ�д���й�F�ĺϳ�·������ͼ�����Լ���ѡ�����ϳ�·������ͼʾ�����£�
H2C=CH2 ![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH ��
CH3CH2OH ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com