
| A. | 分子之间有间隔 | B. | 分子的质量很小 | C. | 分子在不断运动 | D. | 分子的体积很小 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
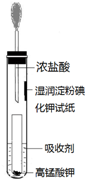 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | A | B | C |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物的水溶液显碱性 | 原子有三个电子层,简单离子在本周期中半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用硫酸铜溶液除去铁粉中混有的铜粉 | |
| B. | 用碳酸钙除去氯化钙溶液中混有的稀盐酸 | |
| C. | 用稀硫酸除去氯化钠中混有的碳酸钠 | |
| D. | 用点燃方法除去二氧化碳中混有的一氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)=2H2O(l)△H=-483.6 kJ•mol-1,则氢气的燃烧热为483.6 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 已知2C(s)+2O2(g)=2CO2(g)△H1 2C(s)+O2(g)=2CO(g)△H2 则△H1<△H2 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若向密闭容器中再充入N2,则反应速率减慢 | |
| B. | 若反应前10s时,H2减少了0.3mol,则v(H2)=0.03mol•L-1•s-1 | |
| C. | 若某时刻N2、H2、NH3的浓度不再发生变化,则表明该反应达到了平衡状态 | |
| D. | 若某时刻消耗了1molN2同时生成了2molNH3,则表明该反应达到了平衡状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com