
分析 ①硫酸铝为强电解质,完全电离出铝离子和硫酸根离子;
②稀硫酸与氧化钠反应生成硫酸钠和水,氧化钠需要保留化学式;
③碳酸氢钠与盐酸反应生成氯化钠、二氧化碳气体和水;
④离子方程式Cu2++2OH-=Cu(OH)2↓表示可溶性铜盐与强碱溶液反应的一类化学反应.
解答 解:①硫酸铝属于强电解质,在溶液中完全电离出铝离子和硫酸根离子,其电离方程式为:Al2(SO4)3=2Al3++3SO42-,
故答案为:Al2(SO4)3=2Al3++3SO42-;
②稀硫酸与氧化钠固体反应生成硫酸钠和水,反应的离子方程式为:2H++Na2O=2Na++H2O,
故答案为:2H++Na2O=2Na++H2O;
③碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,离子反应为:H++HCO3-=H2O+CO2↑,
故答案为:H++HCO3-=H2O+CO2↑;
④可溶性铜盐和强碱反应生成氢氧化铜蓝色沉淀,反应方程式为:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,
故答案为:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4.
点评 本题考查了离子方程式、电离方程式、化学方程式的书写,明确物质的性质及离子反应方程式、化学方程式、电离方程式的书写规则是解本题关键,知道离子方程式表示一类反应,反应方程式表示一个反应.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
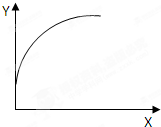 在一密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)=2C(g)+Q(Q>0),当达到平衡后,改变一个条件(X),下列量(Y)一定符合图中曲线的是( )
在一密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)=2C(g)+Q(Q>0),当达到平衡后,改变一个条件(X),下列量(Y)一定符合图中曲线的是( )| X | Y | |
| A | 温度 | 混合气体平均相对分子质量 |
| B | 再加入C | A的质量分数 |
| C | 再加入A | B的转化率 |
| D | 压强 | B的浓度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
| A. | 单质与氢气化合的难易程度:Z>L | |
| B. | Y的氧化物对应的水化物不能溶于过量的氨水 | |
| C. | Z单质在氧气中燃烧生成ZO3 | |
| D. | L、Q形成的简单离子核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
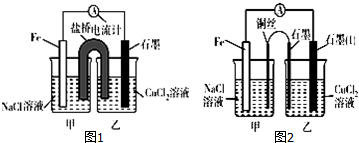
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
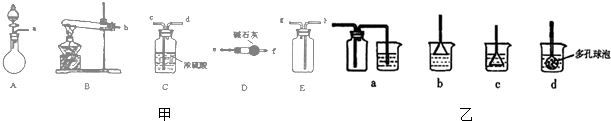
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
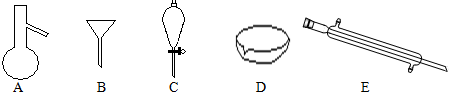
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题:
运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com