
| A. | 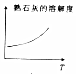 | B. |  | C. | 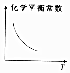 | D. | 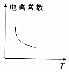 |
分析 A.氢氧化钙的溶解度随着温度的升高而降低;
B.温度越高,反应速率越快;
C.升高温度,化学平衡向吸热方向移动;
D.升高温度促进弱电解质的电离.
解答 解:A.氢氧化钙的溶解度随着温度的升高而降低,图象中氢氧化钙的溶解度随温度的升高而增大,与实际不符,故A错误;
B.升高温度能提高活化分子的百分数,反应速率加快,所以温度越高,反应速率越快,故B正确;
C.升高温度,化学平衡向吸热方向移动,若正方向为放热反应,则平衡常数减小,若正方向为吸热反应,则平衡常数增大,故C错误;
D.弱电解质的电离为吸热过程,升高温度促进电离,则升高温度电离常数增大,故D错误.
故选B.
点评 本题考查了温度对溶解度的影响、影响反应速率的因素、温度对平衡常数的影响、电解质的电离常数,题目难度不大,侧重于考查学生对基础知识的应用能力,注意把握影响溶解度、反应速率、平衡常数、电离常数的因素.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:4 | B. | 3:11 | C. | 1:11 | D. | 21:22 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铜铸塑像上出现铜绿[Cu2(OH)2CO3] | |
| B. | 灶具大理石板被食醋腐蚀变得不光滑 | |
| C. | 小苏打可用于治疗胃酸过多 | |
| D. | 用煤气灶燃烧天然气为炒菜提供热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ | |
| C. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
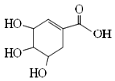
| A. | 分子式为C7H6O5 | B. | 分子中含有两种官能团 | ||
| C. | 1mol该有机物能与4molNaOH反应 | D. | 可发生加成和取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铵和草木灰混合使用,能增强化肥的肥效 | |
| B. | 二氧化硫和漂白粉混合使用,能增强漂白效果 | |
| C. | 浓盐酸和高锰酸钾混合使用,能增强高锰酸钾的氧化性 | |
| D. | 氢氧化钠固体和氧化钙混合使用,能增加吸水能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com