
【题目】X、Y、Z、W 是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,W的原子序数是 Z的两倍,由这四种元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两种常见的金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色 晶体。下列说法正确的是
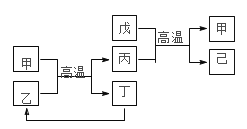
A.W金属性强于 Z
B.W 元素在周期表中的位置是第四周期 VIII 族
C.丙属于两性氧化物
D.等物质的量的甲和戊完全溶于稀硝酸,消耗的 HNO3的量一定相等
【答案】B
【解析】
前四周期元素X、Y、Z、W 的推导:丙为具有磁性的黑色晶体,可判断丙为Fe3O4,则含Fe和O两种元素;丁是非金属,则甲和乙在高温条件下生成丙(Fe3O4)和单质丁可判断为反应:3Fe + 4H2O ![]() Fe3O4 + 4H2↑,所以丁为H2;X、Z的周期序数=族序数,可判断为H、Be、Al或Ge中的两种,由于W的原子序数是 Z的两倍,可判断Z是Be或Al;甲、戊是两种常见的金属单质,则丙(Fe3O4)和戊在高温条件下的反应可判断为:8Al + 3Fe3O4
Fe3O4 + 4H2↑,所以丁为H2;X、Z的周期序数=族序数,可判断为H、Be、Al或Ge中的两种,由于W的原子序数是 Z的两倍,可判断Z是Be或Al;甲、戊是两种常见的金属单质,则丙(Fe3O4)和戊在高温条件下的反应可判断为:8Al + 3Fe3O4 ![]() 4Al2O3 + 9Fe,Z为Al。总之,原子序数依次增大的前四周期元素X、Y、Z、W分别是H、O、Al、Fe,甲、乙、丙、丁、戊、己分别是Fe、H2O、Fe3O4、H2、Al、Al2O3。可在此基础上对各选项作出判断。
4Al2O3 + 9Fe,Z为Al。总之,原子序数依次增大的前四周期元素X、Y、Z、W分别是H、O、Al、Fe,甲、乙、丙、丁、戊、己分别是Fe、H2O、Fe3O4、H2、Al、Al2O3。可在此基础上对各选项作出判断。
A. 根据金属活动性顺序表可知,Al比Fe活泼,所以W(Fe)金属性弱于Z(Al),A选项错误;
B. W是Fe,原子序数为26,在周期表中的位置是第四周期Ⅷ族,B选项正确;
C. 丙是Fe3O4,属于碱性氧化物,C选项错误;
D. 甲溶于稀硝酸:4HNO3(稀) + Fe(不足) === Fe(NO3)3 + NO↑ + 2H2O或8HNO3(稀) + 3Fe(足量) === 3Fe(NO3)2 + 2NO↑ + 4H2O,等量的Fe消耗的HNO3不确定;戊溶于稀硝酸:4HNO3(稀) + Al = Al(NO3)3 + NO↑ + 2H2O。所以等物质的量的甲和戊完全溶于稀硝酸,消耗的HNO3的量不一定相等,D选项错误;
答案选B。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】某课外活动小组,将剪下的一块镀锌铁皮放入试剂瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图装置进行实验。数分钟后观察,下列现象不可能出现的是( )

A.B中导管里形成一段水柱B.锌被腐蚀C.金属片剪口处溶液变红 D.B中导管产生气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
①一氧化碳严重中毒需要放入高压氧舱中②二氧化氮与四氧化二氮的平衡体系,加压缩小体积后颜色加深③实验室可用排饱和食盐水的方法收集氯气④自来水厂用液氯消毒处理时加少量液氨⑤钠与氯化钾共融制备Na(l)+KCl(l) ![]() K(g)+NaCl(l)
K(g)+NaCl(l)
A.①③B.②C.③④D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭系统中有反应C(s)+CO2(g) ![]() 2CO(g),能使反应速率加快的措施是
2CO(g),能使反应速率加快的措施是
①通过减小容器体积增大压强 ②升高温度 ③将炭粉碎 ④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2使得压强增大
A. ①②③⑥B. ①②④⑥C. ①②③④D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属钯催化的偶联反应是近年来有机合成的热点之一,如反应①:

化合物II可由以下合成路线获得:

(1)化合物I所含官能团的名称为______________,化合物II的分子式为_____________。
(2)化合物IV的结构简式为______________________,某同学设想无需经反应②、③、④和⑤,直接用酸性KMnO4溶液就可将化合物III氧化为化合物VII,该设想明显不合理,其理由是__________________________________________________________。
(3)化合物VII有多种同分异构体,请写出一种符合下列要求的结构简式____________。
i)苯环上有两个取代基
ii)1 mol 该物质发生银镜反应能生成4 mol Ag
(4)反应⑥的化学方程式为________________________________________。(注明条件)
(5)化合物![]() 与化合物
与化合物![]() 在一定条件下按物质的量之比1∶2可发生类似反应①的反应,请写出其产物的结构简式________________________________。
在一定条件下按物质的量之比1∶2可发生类似反应①的反应,请写出其产物的结构简式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用如图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)

实验操作和现象:
操作 | 现象 |
关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
打开弹簧夹,通入N2, 停止加热,一段时间后关闭 | |
从B、C中分别取少量白色沉淀,加稀盐酸 | 尚未发现白色沉淀溶解 |
(1)C中白色沉淀是___,该沉淀的生成表明SO2具有___性。
(2)C中液面上方生成浅棕色气体的化学方程式是___。
(3)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是___;乙在A、B间增加洗气瓶D,D中盛放的试剂是___。
②进行实验,B中现象:
甲 | 大量白色沉淀 |
乙 | 少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:___。
(4)合并(3)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究青铜器(含Cu、Sn等)在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图,下列说法不正确的是
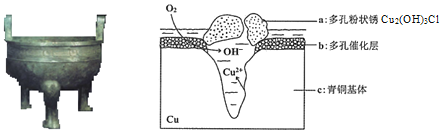
A.青铜器发生吸氧腐蚀,图中c作负极,被氧化
B.正极发生的电极反应为O2+ 4e-+2H2O=4OH-
C.若生成0.2 mol Cu2(OH)3Cl,则理论上消耗的O2体积为4.48L
D.环境中的Cl-与电极产物生成a的离子方程式为2Cu2++3OH-+Cl-=Cu2 (OH)3Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( )

A. 气态氢化物的稳定性:R>W
B. X与Y可以形成原子个数比为1∶1和1∶2的两种离子化合物
C. 由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是X2-
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E 五种元素的原子序数依次增大,B、C 的阳离子与A的阴离子和氖原子的电子层结构相同;A、B可形成离子化合物B2A;C的氧化物既能与强酸反应,又能与强碱反应;D的原子结构示意图为: ;E的最外层电子数是电子层数的2倍。试回答下列各问题:
;E的最外层电子数是电子层数的2倍。试回答下列各问题:
(1)B、D元素分别为_________、_________;
(2)D元素位于元素周期表中第_______周期、第______族;
(3)化合物B2A的电子式____________________;
(4)E的最高价氧化物的水化物的分子式是________________________。
(5)D与NaOH溶液反应的化学方程式:_______________________________。
(6)C的氧化物与E的最高价氧化物的水化物溶液反应的离子方程式: ________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com