
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁丝在氧气中燃烧生成黑色固体物质 | |
| B. | 给水通直流电一段时间,正极和负极的气体体积比为2:1 | |
| C. | 二氧化碳通入紫色石蕊试液,紫色石蕊试液变成红色 | |
| D. | 红磷在空气中燃烧,产生大量白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上学期月考三化学试卷(解析版) 题型:选择题
将H2S和空气的混合气体通入FeCl3 、FeCl2 、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列叙述正确的是( )

A.在图示的转化中,化合价不变的元素只有铜
B.由图示的转化可得出氧化性的强弱顺序:O2>Fe3+>S
C.在图示的转化中,发生的反应有:H2S+Cu2+=CuS↓+2H+
D.在图示的转化中,发生的反应有:4Fe2++O2+2H2O=4Fe3++4OH-
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上学期月考三化学试卷(解析版) 题型:选择题
赏心悦目的雕花玻璃是用下列哪种物质对普通玻璃进行刻蚀而制成的,该物质是( )
A.氢硫酸 B. 氢氟酸 C.浓硫酸 D.浓硝酸
查看答案和解析>>
科目:高中化学 来源:2017届广西桂林十八中高三上10月月考化学试卷(解析版) 题型:选择题
金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是( )
A.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于 氧气扩散至电极表面
氧气扩散至电极表面
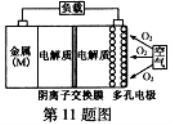 B.比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
B.比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
C.M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D.在M–空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com