
【题目】氧化还原反应在生产和生活中使用非常广泛.
I、NaNO2外观和食盐相似,又有咸味,容易使人误食中毒.已知NaNO2能发生如下反应:
2NaNO2+4HI═2NO↑+I2+2NaI+2H2O.
(1)上述反应中用单线桥标出电子转移的方向和数目.
(2)某厂废液中,含有2%~5%的NaNO2 , 直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是 .
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(3)II.过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.根据下列反应回答问题:
A.Na2O2+2HCl═2NaCl+H2O2
B.Ag2O+H2O2═2Ag+O2↑+H2O
C.2H2O2═2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH═2K2CrO4+3K2SO4+8H2O
上述反应中,H2O2仅体现氧化性的反应是(填序号)
(4)上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序是
(5)某酸性反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、MnO4﹣、H2O、Mn2+、H2O2、H+ . 已知该反应中H2O2只发生了如下过程:H2O2→O2 .
①将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中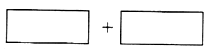
②如果上述反应中有6.72L(标准状况)气体生成,转移的电子为 mol.
【答案】
(1)
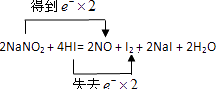
(2)B
(3)D
(4)Ag2O>H2O2>K2CrO4
(5)0.6
【解析】解:(1)N元素的化合价由+3降低为+2,I元素的化合价由﹣1升高为0,则双线桥表示电子转移的方向和数目为 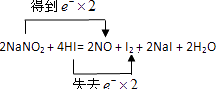 ,
,
所以答案是: 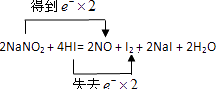 ;(2)NaNO2→N2是被还原,必须加还原剂;N元素氧化性弱于O和Cl元素,故只能加NH4Cl作还原剂.方程式为NaNO2+NH4Cl═NaCl+N2↑+2H2O,亚硝酸钠中氮得到3电子指向氮气中的氮,氯化铵中氮失去3电子指向氮气中的氮,
;(2)NaNO2→N2是被还原,必须加还原剂;N元素氧化性弱于O和Cl元素,故只能加NH4Cl作还原剂.方程式为NaNO2+NH4Cl═NaCl+N2↑+2H2O,亚硝酸钠中氮得到3电子指向氮气中的氮,氯化铵中氮失去3电子指向氮气中的氮,
所以答案是:B;(3)A中无元素的化合价变化,B中Ag元素的化合价降低、双氧水中O元素的化合价升高,B中过氧化氢具有还原性,C中双氧水中氧元素化合价升高也降低,体现还原性和氧化性,只有D中双氧水中氧元素化合价降低,说明双氧水作氧化剂,体现了氧化性,所以答案是:D;(4)反应Ag2O+H2O2=2Ag+O2↑+H2O中,氧化银做氧化剂,双氧水作还原剂,则氧化性Ag2O>H2O2 , 反应3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O中,双氧水做氧化剂,铬酸钾做氧化产物,则氧化性H2O2>K2CrO4 , 则氧化性顺序为Ag2O>H2O2>K2CrO4 ,
所以答案是:Ag2O>H2O2>K2CrO4 . (5)①该反应过程中,高锰酸根的氧化性和双氧水的还原性导致二者间发生氧化还原反应,高锰酸根离子中锰元素从+7变为+2价,化合价降低5价,双氧水中氧元素化合价从﹣1价变为0价,化合价至少升高2价,则高锰酸根离子的系数为2,双氧水的系数为5,然后利用质量守恒配平可得该反应的离子方程式为:2MnO4﹣+5H2O2+6H+=2Mn2++8H2O+5O2↑,
所以答案是:2MnO4﹣+5H2O2;②上述反应中生成5mol氧气转移电子10mol,当反应中有6.72L(标准状况)即0.3mol氧气生成时,则转移的电子为:10mol× ![]() =0.6mol,
=0.6mol,
所以答案是:0.6.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】从海水中提取溴常用的一种工艺涉及以下过程:
①氧化:用Cl2将海水中的NaBr氧化成Br2;
②将海水浓缩;
③提取:用Cl2将HBr氧化成Br2得到产品;
④富集:用空气和水蒸气将Br2吹入吸收塔与吸收剂SO2水溶液反应生成HBr;则正确的步骤为( )
A. ②①③④ B. ①②③④ C. ②①④③ D. ③②①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷是第ⅤA族元素,黄砷(As4)是砷元素的一种单质,其分子结构与白磷(P4)相似。下列关于黄砷和白磷的叙述正确的是()
A.黄砷和白磷分子中共价键的键角均为109.5o
B.黄砷分子中共价键的键能大于白磷分子
C.黄砷分子的极性大于白磷分子
D.黄砷的熔点高于白磷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求对下图中两极进行必要的联接并填空:

(1)在A图中,使铜片上冒H2气泡。请加以必要联接__________(在答题卡的图中画线),则联接后的装置叫_________。电极反应式:锌板:____________________;铜板:___________。
(2)在B图中(a、b均为惰性电极),使a极析出铜,则b析出____________。加以必要的联接后,该装置叫___________。电极反应式:a极:___________________________b极:____________________________。经过一段时间后,停止反应并搅均溶液,溶液的pH值________________(升高、降低、不变),加入一定量的____________后,溶液能恢复至与电解前完全一致。
(3)工业上利用甲烷和氧气直接氧化制取甲醇的反应如下:
CH4+![]() O2(g) ==== CH3OH(g) △H=-128.5kJ/mol
O2(g) ==== CH3OH(g) △H=-128.5kJ/mol
副反应有:CH4(g)+![]() O2(g) ==== CO(g)+2H2O(g) △H=a kJ/mol
O2(g) ==== CO(g)+2H2O(g) △H=a kJ/mol
CH4(g)+2O2(g) ==== CO2(g)+2H2O(g) △H=b kJ/mol
CH4(g)+O2(g) ==== HCHO(g) +H2O(g) △H=c kJ/mol
甲醇与氧气反应生成HCHO(g)和水蒸汽的热化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关,下列说法不正确的是
A. 用食醋可除去热水壶内壁的水垢
B. 医用酒精的浓度通常为95%
C. 烹鱼时加适量醋和酒可以增加香味
D. 碘盐中的碘不可以直接用淀粉检验
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com