
金属镁及其化合物不仅在国防上有重要应用,在化学
研究中也有广泛应用。
(1)某同学研究反应速率时用如下方法:
取一段镁条,用砂纸擦去表面的氧化膜,使足量
镁条与一定量盐酸反应生成H2的量与反应时间
 的关系曲线如图所示。镁与盐酸反应的离子方程
的关系曲线如图所示。镁与盐酸反应的离子方程
式为 ;
在前4min内,镁条与盐酸的反应速率逐渐加快,
在4 min之后,反应速率逐渐减慢,请简述其原因:_____________。
(2)向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解,
写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
(3)Mg Al可形成原电池:
| 编号 | 电极材料 | 电解质溶液 | 电子流动 方向 |
| 1 | Mg Al | 稀盐酸 | Mg流向Al |
| 2 | Mg Al | NaOH溶液 |
根据上表中的实验现象完成下列问题:
①实验1中Mg为 极;
②实验2中电子流动方向 ,Al为 极,为什么? 。
科目:高中化学 来源: 题型:
已知氢化锂(LiH)属于离子化合物,LiH跟水反应可以反出氢气。下列叙述正确的是
A.LiH跟水反应时的水溶液显中性 B.LiH中氢离子可以被还原成氢气
C.LiH在化学反应中是一种强氧化剂 D.LiH中氢离子半径比锂离子半径大
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究溴乙烷与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三
名同学分别设计如下三个实验方案:
甲:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
乙:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成, 则可证明发生了消去反应。
丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则证明发生了消去反应。
则有关上述实验方案叙述( )
A. 甲正确 B. 乙正确 C. 丙正确 D. 上述实验方案都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH小于4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;
若pH<7,则H2A是强酸
C.用0.200 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的
浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度: ④>①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列影响化学反应的本质原因分析错误的是
A.增大反应物浓度,单位体积内活化分子数增多,有效碰撞几率增加
B.有气体参加的化学反应,若缩小反应容器的体积,主要增大了活化分子的百分数
C.升高温度,主要增加了反应物分子中活化分子数
D.加入催化剂后,活化分子数增大,活化分子百分数也增大
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应2SO2(g)+O2(g) 2SO3(g) △H<0,在一定条件下达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如右图所示。下列说法正确的是
2SO3(g) △H<0,在一定条件下达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如右图所示。下列说法正确的是
A. 维持温度、容积不变,t1时充入SO3(g)
B. 维持压强不变,t1时升高反应体系温度
C. 维持温度、容积不变,t1时充入一定量Ar
D. 维持温度、压强不变,t1时充入SO3(g)

查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加几滴浓盐酸后,立即用另一培养皿扣在上面。

对实验现象的“解释或结论”正确的是( )
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 还原性:Fe2+>C1一 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A.金属铝投入到氢氧化钠溶液中:2Al+2OH-=2 AlO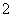 +H2↑
+H2↑
B.AlCl3溶液中加入足量的氨水:Al3++ 3OH-=Al(OH)3↓
C.三氯化铁溶液中加入铁粉 Fe3++Fe = 2Fe2+
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2 = 2Fe3++2Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com