
| A. | 二氧化硅用于制作电脑芯片和光导纤维 | |
| B. | 硫磺用于配制黑火药和工业生产硫酸 | |
| C. | 氯气用于城市自来水消毒和生产漂白粉 | |
| D. | 钾钠合金用作原子反应堆的导热剂 |
分析 A、电脑芯片是硅;
B、硫和氧气反应生成二氧化硫,工业上生产硫酸时原料的选择要根据不同国家、不同地区矿石的分布情况确定,可选S作为原料;
C、氯气与水反应生成次氯酸消毒和氯气与氢氧化钙反应生产漂白粉;
D、钠与钾合金的熔点降低可作原子反应堆导热剂.
解答 解:A、电脑芯片是硅,而不是二氧化硅,故A错误;
B、工业上生产硫酸时,第一步:SO2的制取,原料的选择要根据不同国家、不同地区矿石的分布情况确定,主要有S、FeS2、FeS、H2S、CuFeS2等含硫矿石,中国因为黄铁矿含量丰富,所以用的是黄铁矿,世界上很多国家都是用的硫磺,而黑火药的成分是单质硫、硝酸钾和木炭,故B正确;
C、氯气与水反应生成次氯酸消毒和氯气与氢氧化钙反应生产漂白粉,故C正确;
D、钠与钾合金的熔点降低可作原子反应堆导热剂,故D正确;
故选A.
点评 该题属于元素化合物的用途,可帮助学生熟悉身边物质的用途,更好的指导我们的生活.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
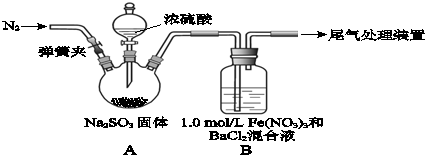
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2 | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | C+H2O═CO+H2 | D. | Cl2+H2O═HCl+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下33.6LH2 | B. | 所含电子的物质的量为4mol的H | ||
| C. | 20℃.45gH2O | D. | 常温下,16gO2,与14gN2的混合气体 | ||
| E. | 含原子总数约为1.204×1024的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,NaClO溶液可用Cl2与NaOH溶液反应获得,写出该反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O
,NaClO溶液可用Cl2与NaOH溶液反应获得,写出该反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 准确称取0.4000g的NaOH固体配成1000mL浓度为0.01000 mol•L-1的溶液 | |
| B. | 用硫粉覆盖地下撒有的汞;用热碱溶液洗去试管内壁的硫;用二氧化碳扑灭金属钠引起的失火;用湿润的红色石蕊试纸检验氨气是否集满;以上操作均合理 | |
| C. | 用激光笔鉴别Fe(OH)3胶体和Fe(SCN)3溶液 | |
| D. | SO2溶于水,其水溶液能导电,说明SO2是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com