
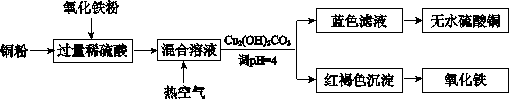
科目:高中化学 来源:不详 题型:单选题
A.Fe在Cl2中的燃烧产物: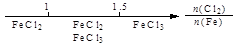 |
B.氨水与SO2反应后溶液中的铵盐: |
C.平衡常数与转化率关系: |
D.Cl2与CH4取代反应后的产物: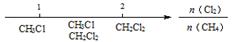 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
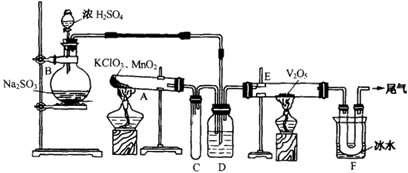
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
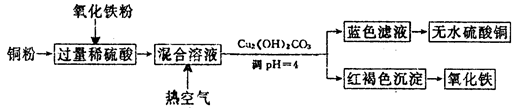
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
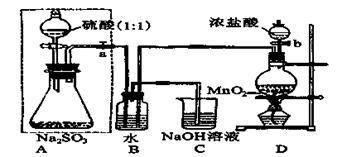
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 2CuO,CuO+H2SO4=CuSO4+H2O。
2CuO,CuO+H2SO4=CuSO4+H2O。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应现象:两者相同 |
| B.消耗硝酸的物质的量:前者多,后者少 |
| C.反应生成气体的颜色:前者浅,后者深 |
| D.反应中转移的电子总数:前者多,后者少 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
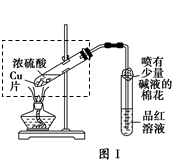
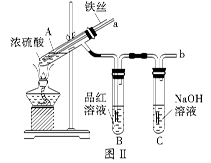
| 步骤 | 所选试剂 | 现象及结论 |
| 1 | | |
| 2 | | |
| 3 | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com