
【题目】某实验小组对含有Al3+的未知溶液进行了如下分析:
(1)滴加少量NaOH溶液,无明显变化;
(2)继续滴加NaOH溶液,有白色胶状沉淀生成;
(3)滴加过量的NaOH溶液,白色胶状沉淀明显减少。
实验小组经定量分析,得出如图所示沉淀的物质的量与滴加NaOH溶液体积的关系。下列说法错误的是 ( )
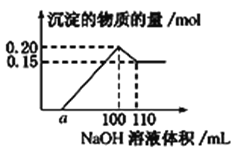
A. 该未知溶液中至少含有3种阳离子
B. NaOH溶液的物质的量浓度为5 mol·L-1
C. 若另一种离子为二价阳离子,则a=40
D. 若将最终沉淀过滤、洗涤、灼烧,其质量可能为6 g
【答案】C
【解析】A. 据图可知,加入NaOH溶液,开始时无沉淀产生,说明溶液中有较多H+,继续滴入氢氧化钠溶液生成白色沉淀,说明一定生成氢氧化铝沉淀,溶液中含有Al3+,加入过量的氢氧化钠溶液沉淀减少但未完全消失,说明溶液中除了铝离子,应还有另一种金属阳离子,该未知溶液中至少含有3种阳离子,故A正确;B. 溶解氢氧化铝消耗的氢氧化钠溶液是10mL,而氢氧化铝的物质的量是(0.20-0.15)mol=0.05mol,则根据反应Al(OH)3+OH=AlO2+2H2O可知,氢氧化钠溶液的物质的量浓度是c(NaOH)=0.05mol÷0.01L=5mol/L,故B正确;C. 若另一种离子为二价阳离子,设该离子为M2+,据图可知,M(OH)2沉淀的物质的量是0.15mol,由M2++2OH=M(OH)2↓可知,生成M(OH)2沉淀时消耗氢氧化钠溶液的体积是V(NaOH)=0.15mol×2÷5mol/L=60mL,氢氧化铝的物质的量是0.05mol,根据Al3++3OH=Al(OH)3↓可知,生成氢氧化铝时消耗氢氧化钠溶液的体积是30mL,所以a=10,故C错误;D. 若另一种二价阳离子为Mg2+,则加入过量NaOH溶液后最终所得沉淀为Mg(OH)2,将沉淀过滤、洗涤、灼烧,所得物质为MgO,其物质的量为0.15mol,质量为6 g,故D正确;答案选C。


科目:高中化学 来源: 题型:
【题目】某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。

可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应![]()
(1)装置①中发生反应的化学方程式是__________
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹通入_________气体(填化学式)一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内。
(3)实验应避免有害气体排放到空气中,装置③中盛放的药品是_________;装置⑥中盛放的药品是_________。
(4)装置②中盛放的药品是_________;该装置的作用是_______________________。
(5)该小组得出的结论所依据的试验现象是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】成环反应在有机合成中具有重要应用,某环状化合物G的合成过程如下: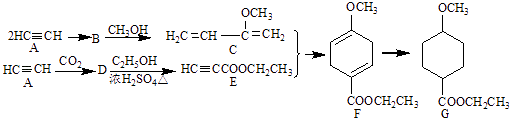
(1)A→B为加成反应,则B的结构简式是;B→C的反应类型是 .
(2)G中含有的官能团名称是;F的化学式为 .
(3)D→E的化学方程式是 .
(4)H是F的同分异构体,具有下列结构特征:①核磁共振氢谱除苯环吸收峰外仅有1个吸收峰;②存在甲氧基(CH3O﹣).H的结构简式是 .
(5)由C通过加聚反应合成的顺式高分子化合物M的化学方程式为 .
(6)下列说法正确的是 . a.A能和HCl反应得到聚氯乙烯的单体 b.D和F中均含有2个π键
c.1molG完全燃烧生成8mol H2O d.F能发生加成反应、取代反应、氧化反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素。下列判断错误的是 ( )
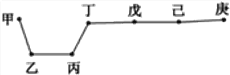
A. 甲可能是金属元素
B. 气态氢化物的稳定性:庚>己>戊
C. 丙与戊的最高价氧化物的水化物可以相互反应
D. 庚的最高价氧化物的水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是( )
A.液溴和苯分别受热变为气体
B.干冰和氯化铵分别受热变为气体
C.二氧化硅和铁分别受热熔化
D.食盐和葡萄糖分别溶解在水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中,有A.B两种气体,反应按下式进行A(g)+B(g)═2C(g)反应经过2S后浓度不再发生变化时,测得容器中各物质的浓度分别为c(A)=0.5mol/L,c(B)=0.75mol/L,c(C)=0.5mol/L.
(1)B物质的起始浓度为
(2)2S时A的转化率
(3)用物质A表示反应的平均速率 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1995年我国科研人员在兰州首次合成了镤元素的一种同位素镤-239,并测知其原子核内有148个中子。现有A元素的一种同位素,比镤-239的原子核内少54个质子和100个中子,则A元素在元素周期表中的位置是
A. 第三周期第IA族 B. 第三周期第IIA族
C. 第四周期第VIIA族 D. 第五周期第IA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下pH=2的两种酸溶液A和B,分别加水稀释1000倍,其pH值与所加水的体积变化如图所示.下列结论正确的是( ) 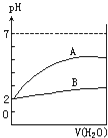
A.酸B比酸A的电离度大
B.A为弱酸,B为强酸
C.酸B的物质的量浓度比A的小
D.A酸比B酸易电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白铁皮在发生析氢腐蚀时有0.2mol电子转移,下列说法正确的是( )
A.有5.6 g金属被腐蚀
B.有6.5 g金属被氧化
C.有0.15 mol金属失去电子
D.标准状况下有4.48 L H2逸出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com